内分泌腺に発生する良性腫瘍は腺腫と呼ばれ、下垂体の微小腺腫は、いくつかの重要なホルモンを生成する下垂体前葉の小さな腫瘍です。
原因 下垂体微小腺腫
専門家は、脳内の内分泌腺である下垂体に微小腺腫が出現する正確な原因を知りません。下垂体の細胞は以下の物質を生成します。
- 副腎皮質刺激ホルモンまたはACTH(副腎皮質刺激ホルモン)は、副腎皮質によるステロイドホルモンの分泌を引き起こします。
- 成長ホルモン STH –成長ホルモン;
- ゴナドトロピン(FSH –卵胞刺激ホルモン)とLH –黄体形成ホルモン。これらは卵巣での女性ホルモンと精巣での男性ホルモンの産生を決定します。
- 乳汁分泌ホルモンプロラクチン(PRL)
- 甲状腺刺激ホルモン(TSH)は、甲状腺によるホルモンの合成を刺激します。
これらの腫瘍の発生は、外傷性脳損傷、下垂体への血液供給不足、脳感染症、または毒素への曝露(浮腫および頭蓋内圧亢進を引き起こす)によって引き起こされると考えられています。
危険因子
遺伝性の多発性内分泌腺腫症1型(MEN1症候群)の家族歴がある場合、下垂体腺腫および微小腺腫の発生率が高くなることが知られています。したがって、DNAの特定の変化に関連する遺伝的に決定されたリスク因子が存在すると考えられます。[ 3 ]
多発性内分泌腫瘍症4型(MEN4):MEN4はサイクリン依存性キナーゼ阻害薬1B(CDKN1B)遺伝子の変異を有し、下垂体腫瘍、副甲状腺機能亢進症、精巣および子宮頸部の神経内分泌腫瘍を特徴とする。[ 4 ]
カーニー複合(CNC):カーニー複合では、腫瘍抑制遺伝子PRKAR1Aの生殖細胞系列変異があり、原発性色素結節性副腎皮質疾患(PPNAD)、精巣腫瘍、甲状腺結節、皮膚の斑状色素沈着、先端巨大症を引き起こします。[ 5 ]
家族性孤立性下垂体腺腫(FIPA)の臨床型は、アリール炭化水素受容体相互作用タンパク質(AIP)遺伝子の遺伝的欠陥を特徴とし、全関連家族の約15%と均質ソマトトロピン家族の50%にみられます。[ 6 ]
家族性孤立性下垂体腺腫(FIPA):アリル炭化水素受容体相互作用タンパク質(AIP)の変異は、全FIPA症例の約15%において、思春期または成人初期に検出されます。これらの腫瘍は典型的には悪性度が高く、ほとんどの場合、成長ホルモンを分泌し、先端巨大症を引き起こします。[ 7 ]
このタイプの腫瘍が、他の内分泌腺および脳構造の機能障害、特に視床下部血管系の変化の結果として発生する可能性も排除されません。視床下部血管系は、神経内分泌の視床下部下垂体系内で、下垂体とその前葉である腺性下垂体の機能を、放出ホルモンとともに調節します。
病因
組織学的には、下垂体腺腫は良性の腫瘍であり、大きさに応じて微小腺腫(最大部で10 mmまで)、大腺腫(10~40 mm)、巨大腺腫(40 mm以上)に分類されます。
下垂体における腫瘍形成の病因を研究する一方で、その前葉の細胞が腫瘍へと過形成変化するメカニズムを解明することはまだできていない。
専門家は、最も説得力のある説の一つは、神経伝達物質およびホルモンであるドーパミン(プロラクチン分泌の主な抑制剤)の代謝の調節異常、および/またはPRL(乳汁分泌細胞)を分泌する下垂体細胞の膜貫通型ドーパミン受容体の機能障害との関連だと考えています。
下垂体微小腺腫のほとんどは散発性ですが、MEN1、マッキューン・オルブライト症候群、ウェルナー症候群、カーニー症候群(またはカーニー複合)といった遺伝学的に決定された神経内分泌症候群の一部として発生する場合もあります。カーニー症候群は、下垂体、副腎、甲状腺、卵巣、精巣などのホルモン(内分泌)腺における良性腫瘍の発生リスク増加と関連しています。
症状 下垂体微小腺腫
下垂体小腺腫は、長期間無症状のままである場合があります。症状は発生部位によって異なり、通常は内分泌機能障害の結果として現れます。これは、1つまたは複数のホルモンの過剰産生に関連するホルモン不均衡の症例で最も一般的な所見です。発生部位から判断すると、ほとんどの場合、これは下垂体前葉の小腺腫です。
下垂体小腺腫には、そのホルモン活性に基づいて様々な種類があります。最も一般的な種類は非機能性腺腫(ホルモン不活性な下垂体小腺腫)と考えられており、これはある程度の大きさに達するまでは症状が現れません。しかし、ホルモン不活性な下垂体小腺腫が増殖すると、周辺の脳構造や脳神経を圧迫する可能性があるため、下垂体小腺腫と前頭葉および側頭葉の頭痛が併発する可能性があり、[ 8 ]、視力障害も発生する可能性があります。[ 9 ]しかし、研究者らが主張するように、非機能性(ホルモン不活性)下垂体腫瘍の96.5%は大腺腫です。[ 10 ]
下垂体(前葉)にホルモン活性型小腺腫が発生し、プロラクチンの分泌が増加することもあります(下垂体プロラクチノーマ)。下垂体前葉の乳腺刺激細胞によるプロラクチン産生の増加は、下垂体小腺腫における高プロラクチン血症と定義されます。
女性では、このような下垂体小腺腫はどのように発現するのでしょうか?病的に高濃度のこのホルモンはエストロゲンの産生を阻害し、最初の兆候として月経周期の異常、すなわち月経が来ない(無月経)または排卵期の異常が見られます。その結果、持続性乳汁漏出性無月経症候群が発症し、妊娠・出産能力が失われます。
男性のプロラクチン分泌下垂体小腺腫は、性欲減退、勃起不全、乳房肥大(女性化乳房)、顔や体の毛の減少を伴う高プロラクチン血症性性腺機能低下症を引き起こす可能性があります。
副腎皮質刺激ホルモン(ACTH)を分泌する活動性微小浮腫は、副腎皮質で過剰なステロイドホルモン(グルココルチコイド)を産生させ、下垂体原因によるイツェンコ・クッシング病を引き起こす可能性があります。
小児では、このような微小腺腫は、頭痛、全身衰弱、体幹への脂肪組織の過剰沈着、骨密度および筋力の低下、帯状の皮膚萎縮(紫色の線条の形)など、副腎皮質機能亢進症(クッシング症候群)の症状として現れることがあります。
活性型ソマトトロピン産生小腺腫では、体内のSTHレベルが上昇します。小児期には、その過剰な同化作用により、ほぼすべての骨の成長が促進され、巨人症につながる可能性があります。成人期には、顔面骨(外見の歪み)や四肢関節軟骨の成長が促進され(四肢のバランスの崩れや指の肥厚につながる)、関節痛、過度の発汗、皮脂分泌、耐糖能障害を伴う先端巨大症を発症する可能性があります。
非常に稀に(1~1.5%の症例)、甲状腺刺激ホルモンを産生する下垂体の微小腺腫が発生することがあります。このホルモンは甲状腺を刺激する作用があるため、患者には洞性頻脈や心房細動、血圧上昇、体重減少(食欲増加を伴う)、神経興奮性および易怒性の増加といった下垂体性甲状腺機能亢進症の臨床症状が見られます。
いわゆる下垂体鞍内小腺腫(同義語:下垂体鞍内小腺腫)は、下垂体全体と同様に、頭蓋底の蝶形骨にある解剖学的鞍型の窪みであるトルコ鞍内に局在します。同時に、下垂体はこの窪みの底、つまり下垂体窩(鞍内領域)に位置しています。用語の大きな違いは、「内部」はラテン語でintra、ギリシャ語でendomであることです。
しかし、鞍上部で増殖する下垂体小腺腫は、腫瘍が下垂体窩の底から上向きに増殖することを意味します。
下垂体の嚢胞性微小腺腫は、閉じた袋状の構造をしており、無症状の形成です。
出血を伴う下垂体の微小腺腫は、下垂体の肥大や下垂体前葉実質の類洞毛細血管、神経血管シナプス、門脈血管の損傷を伴う脳卒中または出血性梗塞の結果である可能性があります。
下垂体小腺腫と妊娠
既に述べたように、プロラクチン産生下垂体小腺腫の女性は、エストロゲン欠乏とGnRH(ゴナドトロピン放出ホルモン)の脈動性分泌の抑制により、通常不妊症となります。妊娠するためには、プロラクチン値が正常化する必要があります。そうでなければ、妊娠は成立せず、あるいは妊娠が最初から中絶されてしまいます。
- 下垂体小腺腫があっても出産は可能ですか?
臨床的に機能している微小腺腫を持つ女性で、ドーパミン作動薬(カベルゴリンまたはドスティネックス)による治療を受けている場合、プロラクチン濃度が正常化し、月経周期と生殖能力が回復する可能性があります。
下垂体小腺腫でも授乳は可能ですか?
出産後、腫瘍の症状がなければ授乳は許可されますが、腫瘍の大きさをモニタリングする必要があります(脳の磁気共鳴画像検査を使用)。腫瘍が大きくなった場合は、授乳を中止します。
- 下垂体小腺腫と体外受精
体外受精には高プロラクチン血症の治療が必要であり、正常なプロラクチン値が 12 か月間安定しており、他の下垂体ホルモンの血清値に異常がない場合に、体外受精の処置を開始できます。
合併症とその結果
下垂体小腺腫の何が危険なのでしょうか?この腫瘍は良性ですが、合併症を引き起こし、特に以下のような影響を及ぼす可能性があります。
- 視床下部-下垂体-副腎系の機能不全を引き起こし、イツェンコ・クッシング病を発症する。
- 女性の月経周期のホルモン調節を乱し、男性の勃起不全につながる。
- 小児の成長遅延および下垂体性小人症(下垂体機能低下症)を引き起こす。
- 骨粗鬆症の発症を引き起こします。
腫瘍が増殖し、視神経線維の交差部(80%の人では下垂体の真上に位置する)を圧迫すると、眼球運動障害(眼筋麻痺)と周辺視野の徐々に低下が起こります。ただし、微小腺腫は通常、このような圧迫を与えるには小さすぎます。
下垂体小腺腫は消失しますか?消失することはありませんが、ホルモン不活性の小児腫瘍は時間の経過とともに大幅に縮小する可能性があります。しかし、約10%の患者では、小腺腫が大きくなることがあります。
診断 下垂体微小腺腫
下垂体小腺腫を診断するには、患者の完全な病歴と臨床検査(下垂体で生成されるホルモン濃度を調べる血液検査、プロラクチン濃度を調べる血清の放射免疫測定など)が必要です。
プロラクチンが正常で下垂体小腺腫がある場合、この腫瘍はホルモン不活性です。しかし、プロラクチノーマの症状がある場合、このような偽陰性結果は、検査ミス、あるいは下垂体茎を圧迫する大腺腫のいずれかによる可能性があります。
さらに、血清中の甲状腺ホルモン(T3およびT4)、免疫グロブリン、インターロイキン-6のレベルなど、追加の検査が必要になる場合もあります。
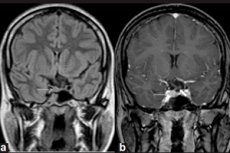
微小腺腫は、脳の磁気共鳴画像(MRI)を用いた機器診断によってのみ検出可能です。微小腺腫のMRIは、造影MRIの感度が90%であることから、画像診断の標準と考えられています。
下垂体小腺腫のMRI所見には、小腺腫側の腺の容積増大、トルコ鞍の増大、下垂体底(下壁)の菲薄化と輪郭の変化、下垂体漏斗部の側方偏位、T1およびT2強調画像における灰白質と比較した丸い領域の等強度、T2強調画像におけるわずかな高強度などがある。[ 11 ]
差動診断
鑑別診断は、頭蓋咽頭腫、下垂体の顆粒細胞腫(コリストーマ)、ラトケ嚢胞、類皮形成、下垂体の炎症(自己免疫性またはリンパ球性下垂体炎)、褐色細胞腫、甲状腺疾患などで行われます。
無排卵周期の女性の場合、無排卵症例の75~90%が多嚢胞性卵巣症候群の結果であるため、下垂体小腺腫と多嚢胞性卵巣症候群は区別されます。
処理 下垂体微小腺腫
下垂体の腺腫および微小腺腫の場合、治療は薬物療法と外科手術の2種類があります。同時に、腫瘍が無症状の場合は、腫瘍の増大を見逃さないよう、定期的にMRI検査を実施し、経過観察することが推奨されます。
特定の薬の処方は、患者の腫瘍の種類によって決まります。
PRL を分泌する腫瘍の薬物療法は、視床下部のドーパミン D2 受容体刺激薬群(選択的ドーパミン作動薬)の薬剤を使用して実施され、プロラクチン分泌増加を伴う下垂体小腺腫に対して最も頻繁に使用されるのはブロモクリプチン(パーロデル、ブロメルゴール)、ノルプロラック、および麦角誘導体のカベルゴリンまたはドスティネックスです。
ドスティネックス(カベルゴリン)の副作用には、アレルギー反応、頭痛やめまい、吐き気、嘔吐、腹痛、便秘、脱力感や疲労感、睡眠障害などがあります。ブロモクリプチンの副作用には(アレルギー反応に加えて)、胸痛、息切れ感を伴う心拍数と呼吸数の増加、喀血、動作協調の障害などがあります。
成長ホルモンを分泌する微小腺腫および巨大腺腫に使用されるオクトレオチド(サンドスタチン)、ランレオチド(ソマチュリン)、ペグビソマントなどの薬剤は、STH の阻害剤であり、その受容体の拮抗薬です。
また、イツェンコ・クッシング症候群を伴う下垂体のACTH分泌腫瘍には、メチラポン(メトピロン)またはミトタン(リソドレン)が使用されます。
機能性(ホルモン活性)微小腺腫に対しては、外科的治療を検討すべきです。保存的治療が無効で、腫瘍がトルコ鞍内で軽度に鞍上部に拡張している場合は、下垂体腺腫摘出術(下垂体微小腺腫を摘出する手術)が処方されることがあります。現在では、経鼻または経蝶形骨洞マイクロダイセクション(鼻から下垂体微小腺腫を摘出する手術)が行われています。
下垂体小腺腫の除去によって起こりうる合併症や結果には、術後出血や脳脊髄液漏出(多くの場合再手術が必要となる)、髄膜炎、視力障害、血腫形成、一過性尿崩症、小腺腫の再発などがあります。
高プロラクチン血症を伴う下垂体小腺腫に対するホメオパシーでは、症状を部分的に緩和する作用を持つ薬剤が使用されます。例えば、月経不順や無月経には、イカ墨セピアを原料としたレメディと、オキナグサ科の植物プルサティラを原料としたレメディが処方され、乳汁分泌症には、ヨーロッパシクラメンの根を原料としたレメディが処方されます。
当然のことながら、下垂体小腺腫の民間療法がより効果的であると期待すべきではありません。この診断において、薬草療法士は患者の訴え(真の病因を知らずに)のみに基づいているだけでなく、多くの「民間療法」が信頼性に欠けているからです。例を挙げればきりがありません。
インターネットの情報源の中には、プロラクチン値を下げるために、サクラソウ、ショウガの根、ゴマを混ぜたものを使うことを推奨しているものもあります。しかし、サクラソウは長引く乾いた咳に効果があり、痰を薄くする効果があり、ショウガの根にはゴマと同様に乳汁分泌を促す作用があります。
バグベインのチンキ剤を服用するというアドバイスも見かけます。しかし実際には、この薬は内服薬として鼓腸に、外用薬としてリウマチ性関節痛に用いられます。バグベインは、更年期のほてりに用いられるブラックコホシュ(別名ブラックコホシュ、ブラックコホシュ)の根と混同されている可能性が高いです。
下垂体小腺腫の栄養はバランスが取れており、糖分と塩分の摂取を控える必要があります。これは特別な食事療法ではなく、単にカロリーを減らすことです。
下垂体小腺腫の場合にはアルコールは除外されます。
下垂体小腺腫の場合、どの医師に診てもらうべきですか? 内分泌科医、婦人科医、脳神経外科医が、この種の腫瘍に伴う問題を治療します。
防止
下垂体腫瘍の環境的または生活習慣的原因は不明であるため、下垂体微小腺腫の発生を予防する方法はまったくありません。
予測
ほとんどの下垂体腫瘍は治癒可能です。ホルモン活性型下垂体小腺腫は早期に診断されれば、回復の可能性は高く、予後は良好です。
障害と下垂体小腺腫:障害は腫瘍の増殖や視神経の損傷、その他この病態に伴う様々な結果を伴う可能性があり、その重症度は個人差があります。患者が障害者と認定されるかどうかは、既存の健康問題と機能障害の程度によって決まり、これらは法的に承認された基準を満たす必要があります。
下垂体小腺腫と軍隊:この腫瘍を持つ患者は(たとえ摘出に成功したとしても)、過熱したり、長時間日光を浴びたり、過度の身体的運動をしたりしてはいけません。そのため、軍隊での任務には適していません。
下垂体小腺腫の患者はどれくらいの期間生きられますか?この腫瘍は癌ではないため、平均余命に制限はありません。ただし、活動性下垂体小腺腫産生小腺腫では、高血圧や心臓肥大を呈する可能性があり、これにより平均余命が大幅に短縮される可能性があります。45歳以上の患者では、イツェンコ・クッシング病や先端巨大症を患っている場合、死亡リスクが上昇することが知られています。


