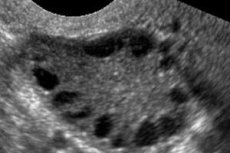
原因 多嚢胞性卵巣症候群
多嚢胞性卵巣症候群は、生殖器系の一般的な内分泌疾患であり、患者の5~10%に発症します。無排卵と原因不明のアンドロゲン過剰を特徴とします。卵巣は正常な大きさの場合もあれば、平滑で肥厚した被膜を伴う腫大の場合もあります。通常、卵巣には26mmの小さな卵胞囊胞が多数存在しますが、閉鎖細胞を含む大きな囊胞がみられる場合もあります。エストロゲンレベルが上昇し、子宮内膜増殖症、ひいては子宮内膜がんのリスクが高まります。アンドロゲンレベルも上昇することが多く、メタボリックシンドロームや多毛症のリスクが高まります。
 [ 13 ]
[ 13 ]
病因
多嚢胞性卵巣症候群(PCOS)の女性は、アンドロゲンとエストロゲンの代謝異常とアンドロゲン合成障害を有します。この疾患は、テストステロン、アンドロステンジオン、デヒドロエピアンドロステロン硫酸塩(DHEA-S)などのアンドロゲンホルモンの血清濃度の上昇を伴います。しかしながら、正常なアンドロゲンレベルが測定される場合もあります。
PCOSはインスリン抵抗性、高インスリン血症、肥満とも関連しています。高インスリン血症はSHBG合成の抑制にもつながり、それが男性ホルモン特性を増強させる可能性があります。
さらに、PCOS におけるインスリン抵抗性は、脂質代謝と血糖値を調節する脂肪細胞から分泌されるホルモンであるアディポネクチンと関連しています。
アンドロゲンレベルの上昇は、下垂体前葉から分泌される黄体形成ホルモン(LH)の刺激作用の増加を伴い、卵巣莢膜細胞の増殖を促します。これらの細胞は、アンドロゲン(テストステロン、アンドロステンジオン)の合成を促進します。一方、LHに比べて卵胞刺激ホルモン(FSH)レベルが低下するため、卵巣顆粒細胞はアンドロゲンをエストロゲンに芳香化することができず、エストロゲンレベルの低下とそれに続く無排卵につながります。
いくつかの証拠は、患者にアンドロゲンの生合成を阻害するシトクロム P450c17、17-ヒドロキシラーゼの機能障害があることを示唆しています。
多嚢胞性卵巣症候群は遺伝的に異質な症候群です。PCOSの家族歴を持つ人々を対象とした研究では、常染色体優性遺伝が証明されています。最近、PCOSと肥満の間に遺伝的関連性があることが確認されました。FTO遺伝子(rs9939609、一般的な肥満の素因となる遺伝子)の変異は、PCOSの発症感受性と有意に関連しています。多嚢胞性卵巣症候群に関連する2p16遺伝子座(2p16.3、2p21、9q33.3)の多型、および黄体形成ホルモン(LH)受容体とヒト絨毛性ゴナドトロピン(hCG)受容体をコードする遺伝子が同定されています。
症状 多嚢胞性卵巣症候群
多嚢胞性卵巣症候群の症状は思春期に始まり、時間の経過とともに軽減します。初潮後しばらくは規則的な月経が続く場合、多嚢胞性卵巣症候群の診断は除外されます。診察では通常、大量の頸管粘液(高エストロゲン血症を反映)が認められます。女性が少なくとも2つの典型的な症状(中等度の肥満、多毛症、月経不順、または無月経)を有する場合、多嚢胞性卵巣症候群の診断が疑われます。
最も一般的な臨床症状の組み合わせは次のとおりです。
- 月経周期障害(稀発月経、機能性子宮出血、続発性無月経)
- 無排卵;
- 不妊;
- 多毛症;
- 脂肪代謝障害(肥満およびメタボリックシンドローム)
- 糖尿病;
- 閉塞性睡眠時無呼吸症候群。
あなたを悩ましているのは何ですか?
診断 多嚢胞性卵巣症候群
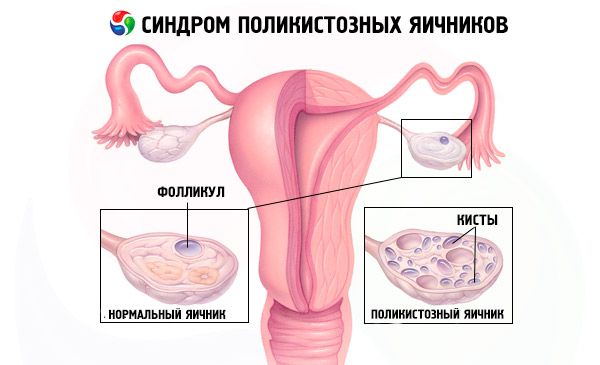
診断は、妊娠の除外(妊娠検査)と血清中のエストラジオール、FSH、TSH、プロラクチンの検査に基づいて行われます。超音波検査では、卵巣に10個以上の卵胞が確認され、診断が確定します。卵胞は通常、卵巣の辺縁部に存在し、真珠のような形をしています。卵巣に卵胞が見られ、多毛症が認められる場合は、テストステロンとDHEASの値を測定する必要があります。病理学的値は無月経と同様に評価されます。
 [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
[ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
病歴と身体検査
綿密な病歴収集により、多嚢胞性卵巣症候群の発症に関わる遺伝的因子を特定します。診察では、BMI(ボディマス指数)とウエスト・ヒップ比(通常0.8以下)を計算し、過体重および肥満を診断します。
多嚢胞性卵巣症候群は、臨床的徴候および検査所見の多型性によって特徴付けられます。
多嚢胞性卵巣症候群の特別な診断方法
月経様反応の3~5日目には、ホルモン検査が必須です。血中LH、FSH、プロラクチン、テストステロン、副腎アンドロゲン(DHEAS)、17-ヒドロキシプロゲステロン濃度を測定します。多嚢胞性卵巣症候群は、LH/FSH指数(LH濃度の上昇による)の上昇(2.5~3)と高アンドロゲン血症を特徴とします。
高アンドロゲン血症の原因を明らかにするため、副腎の21-ヒドロキシラーゼ酵素をコードする遺伝子の変異によって引き起こされる高アンドロゲン血症との鑑別診断(潜在性および潜伏性副腎性器症候群の診断)としてACTH検査を実施します。検査方法:午前9時に肘静脈から採血し、シナクテンデポ製剤1mgを筋肉内投与します。9時間後に再度採血を行います。両血液中のコルチゾールと17-ヒドロキシプロゲステロンの濃度を測定し、特別な式を用いて係数を計算します。係数の値は0.069を超えてはなりません。これらの場合、検査は陰性であり、女性(または男性)は21-ヒドロキシラーゼ遺伝子変異の保因者ではありません。
ジフェニン試験は、多嚢胞性卵巣症候群の中枢型を検出し、神経伝達物質薬による治療の可能性を判断するために行われます。検査方法:まず、血中のLHとテストステロンの濃度を測定し、次にジフェニンを1錠ずつ1日3回、3日間服用します。その後、同じホルモンの血中濃度を再度測定します。LHとテストステロンの濃度が低下した場合、検査は陽性と判断されます。
- 性器の超音波検査では、卵巣の肥大(10 cm3以上)、直径最大9 mmの複数の卵胞、卵巣間質の肥厚、および卵巣嚢の肥厚が明らかになります。
- さらに、インスリン抵抗性が疑われる場合は、運動前後のインスリンおよび血糖値を測定するブドウ糖負荷試験が行われます。
- 多嚢胞性卵巣症候群の副腎起源が疑われる場合は、遺伝カウンセリングとHLA遺伝子型検査が推奨されます。
- 子宮卵管造影検査。
- 腹腔鏡検査。
- 配偶者の精子の生殖能力の評価。
2015年11月、米国臨床内分泌学会(AACE)、米国内分泌学会(ACE)、およびアンドロゲン過剰・PCOS学会(AES)は、PCOSの診断に関する新しいガイドラインを発表しました。これらのガイドラインは以下のとおりです。
- PCOS の診断基準には、慢性無排卵、臨床的アンドロゲン過剰症、多嚢胞性卵巣疾患の 3 つの基準のいずれかが含まれている必要があります。
- PCOS を診断するには、臨床所見に加えて、血清中の 17-ヒドロキシプロゲステロンと抗ミュラー管ホルモンのレベルを測定する必要があります。
- 遊離テストステロンのレベルは、総テストステロンのレベルよりもアンドロゲン過剰の検出に敏感です。
何を調べる必要がありますか?
どのように調べる?
どのようなテストが必要ですか?
連絡先
処理 多嚢胞性卵巣症候群
無排卵性月経周期(月経がない、または不規則な月経の履歴があり、プロゲステロン産生の証拠がない)があり、多毛症がなく、妊娠を希望していない女性には、子宮内膜増殖症および癌のリスクを減らし、血中のアンドロゲン濃度を低下させるために、間欠的プロゲスチン(例、メドロキシプロゲステロン5~10mgを経口で1日1回、毎月10~14日間、12カ月間投与)または経口避妊薬が投与される。
無排卵周期で多毛症を呈し、妊娠を計画していない多嚢胞性卵巣症候群の女性の場合、治療は多毛症を軽減し、血清中のテストステロン値とDHEAS値を調節することを目指します。妊娠を希望する女性は不妊治療を受けます。
多嚢胞性卵巣症候群における不妊治療は2段階で行われます。
- ステージ 1 - 準備;
- ステージ2 – 排卵刺激。
準備段階での治療は、多嚢胞性卵巣症候群の臨床的および病因的形態に応じて異なります。
- 多嚢胞性卵巣症候群および肥満の場合、インスリン抵抗性を軽減する薬の処方が推奨されます。選択される薬はメトホルミンで、1回500 mgを1日3回、3~6か月間経口投与します。
- 多嚢胞性卵巣症候群の卵巣型および高LHレベルの場合、視床下部-下垂体系の感受性を低下させて卵巣機能を完全に抑制する薬剤が使用されます(血清エストラジオール値 < 70 pmol/l)。
- ブセレリンスプレー、月経周期の21日目または2日目から1日3回、各鼻孔に150マイクログラムを1~3ヶ月間投与、または
- ブセレリンデポ剤を月経周期の21日目または2日目から28日ごとに1回3.75mgを筋肉内に投与する。投与期間は1~3ヶ月、または
- リュープロレリン皮下注射3.75mgを月経周期の21日目または2日目から28日ごとに1回、1~3ヶ月間投与する。
- トリプトレリンを皮下注射で3.75 mgを28日ごとに1回、または月経周期の21日目または2日目から1日1回0.1 mgを1~3か月間投与する。
GnRHアゴニストを月経周期のどの日から(21日目または2日目から)処方するかは原則として問題ではありませんが、卵巣嚢胞が形成されないため、21日目からの処方が望ましいです。月経周期の2日目から処方すると、GnRHアゴニストの作用機序における抑制期に先立つ活性化期が卵胞期と重なり、卵巣嚢胞の形成を引き起こす可能性があります。
代替薬:
- エチニルエストラジオール/ジエノゲストを経口投与し、月経周期の5日目から25日目まで1日1回30mcg/2mgを投与する。投与期間は3~6ヶ月または
- エチニルエストラジオール/シプロテロンアセテートを経口投与し、1日1回35mcg/2mgを月経周期の5日目から25日目まで投与する。投与期間は3~6ヶ月。
- 副腎型の多嚢胞性卵巣症候群では、グルココルチコイド薬の投与が適応となります。
- デキサメタゾンを経口で0.25~1mg、1日1回、3~6ヶ月間投与、または
- メチルプレドニゾロンを経口で1日1回2~8mg、3~6ヶ月間投与、または
- プレドニゾロンを経口で1日1回2.5~10 mg、3~6か月間投与する。
- 多嚢胞性卵巣症候群の中枢型には抗てんかん薬が使用されます。
- ジフェニン1錠を1日1~2回経口服用する。
- カルバマゼピンを経口で1日2回100 mg、3~6か月間投与する。
第2段階では排卵誘発が行われます。
薬剤の選択と投与計画は、臨床データと検査データを考慮して決定されます。排卵誘発中は、刺激された周期における超音波検査とホルモンモニタリングを慎重に実施します。
超音波検査なしで、いかなる薬剤を用いても排卵誘発を行うことは認められません。卵巣に嚢胞状形成があり、その直径が15mmを超え、子宮内膜の厚さが5mmを超えている場合は、排卵誘発を開始することは不適切です。
クロミフェンによる排卵誘発は、病気の病歴が短く、十分なエストロゲンレベル(血清エストラジオール < 150 pmol/l)と低い LH レベル(> 15 IU/l)を持つ若い女性に適応されます。
クロミフェンは、月経周期の5日目から9日目まで、同じ時間に1日1回100 mgを経口投与します。
周期10日目にコントロール超音波検査を行い、主席卵胞の直径と子宮内膜の厚さを評価します。排卵期前後には、隔日で毎日検査を行います。重要なのは周期の日付ではなく、主席卵胞の大きさです。主席卵胞の直径が16mmを超える場合は、20mmに達するまで毎日超音波検査を行う必要があります。
代替治療法(顕著な抗エストロゲン効果を伴う)
スキーム1:
- クロミフェン100mgを月経周期の5日目から9日目まで、毎日同じ時間に経口投与する。
- エチニルエストラジオール(EE)を経口投与し、月経周期の10日目から15日目まで1日2回50mcgを服用する。
- 月経周期の10日目から15日目まで、エストラジオールを1回2mg、1日2回経口投与する。
スキーム2:
- クロミフェン100mgを月経周期の3日目から7日目まで、毎日同じ時間に1回経口投与する。
- 月経周期の7~8日目から、または
- 月経周期の7~8日目から、フォリトロピンアルファ75~150 IUを1日1回同じ時間に筋肉内注射します。
以下の状況では、クエン酸クロミフェンによる排卵誘発は適応されません。
- 低エストロゲン症(血清エストラジオール値 < 150 pmol/l)の場合
- GnRHアゴニストによる予備治療後(視床下部-下垂体-卵巣系の感受性の低下の結果として、低エストロゲン症が発生します)
- 生殖年齢が高く、病歴が長く、血清LH値が高い(15 IU/L超)女性の場合、反復刺激療法中にクロミフェンの用量を150 mg/日まで増量することは、末梢性抗エストロゲン作用の悪化を招くため、不適切です。
クロミフェン刺激を 3 回以上連続して行うことは推奨されません。治療が効果がない場合には、ゴナドトロピンを使用する必要があります。
ゴナドトロピンによる排卵刺激は、クロミフェン刺激後に十分な卵胞形成が見られない場合、顕著な末梢抗エストロゲン作用がある場合、エストロゲン飽和度が不十分な場合に適応となります。若年患者にも生殖年齢後期の患者にも実施可能です。
選択する薬剤:
- メノトロピン150~225 IUを月経周期の3~5日目から同時に1日1回筋肉内投与し、7~15日間投与する。
- ウロフォリトロピン150~225 IUを月経周期の3~5日目から同時に1日1回筋肉内注射し、7~15日間投与する。
代替薬(卵巣過剰刺激症候群の発症リスクが高い場合)
- フォリトロピンアルファ100~150 IUを月経周期の3~5日目から1日1回、同時に筋肉内投与し、7~15日間投与する。血清中の黄体形成ホルモン(LH)が高値(15 IU/L超)を示す多嚢胞性卵巣症候群の場合は、GnRHアナログを用いたゴナドトロピンによる排卵誘発が適応となる。
選択する薬剤:
- 月経周期の21日目から、ブセレリンを1日3回、各鼻孔に150マイクログラムのスプレーで噴霧する。
- 月経周期の21日目に1回、ブセレリンデポ剤3.75 mgを筋肉内投与する。
- 月経周期の21日目にリュープロレリン3.75mgを皮下投与する。
- トリプトレリンを月経周期の21日目に1回3.75 mg皮下投与するか、月経周期の21日目から1日1回0.1 mgを皮下投与する。
- 次の月経周期の2~3日目から同時に、メノトロピン225~300 IUを1日1回筋肉内注射します。
代替薬(卵巣過剰刺激症候群の発症リスクが高い場合)
- メノトロピン150~225 IUを月経周期の2~3日目から同時に、または
- フォリトロピンアルファ150~225 IUを月経周期の2~3日目から1日1回同時に筋肉内投与する。
- ゴナドトロピン使用開始5~7日目(主席卵胞が13~14 mmの大きさに達した時点)から、ガニレリクス0.25 mgを1日1回皮下投与する。
- ゴナドトロピン使用開始5~7日目(主席卵胞が13~14 mmの大きさに達した時点)から、セトロレリクス0.25 mgを1日1回皮下投与する。
生殖年齢が遅い患者(性腺刺激薬に対する卵巣の反応が弱い)における排卵誘発。
選択する薬剤:
- 月経周期の3日目から5日目まで、1日1回225 IUを筋肉内注射し、同時に投与する。
- 月経周期の2日目からトリプトレリン0.1mgを1日1回皮下投与する。
代替薬:
- トリプトレリン0.1mgを月経周期の2日目から1日1回皮下投与+
- 月経周期の3日目から5日目まで、同時にフォリトロピンアルファ200~225 IUを1日1回筋肉内注射します。
ゴナドトロピンを使用するすべての計画において、ゴナドトロピンの投与量の適切性は卵胞の成長(通常2mm/日)の動態によって評価されます。卵胞の成長が遅い場合は投与量を75IU増加し、成長が速すぎる場合は投与量を75IU減少させます。
いずれの計画でも、18~20 mm の成熟卵胞があり、子宮内膜の厚さが 8 mm 以上の場合は治療を中止し、ヒト絨毛性ゴナドトロピンを 10,000 IU の単回投与で筋肉内投与します。
排卵が確認された後は、周期の黄体期をサポートします。
選択する薬剤:
- ジドロゲステロンを経口投与し、1日1~3回10mgを10~12日間投与する。
- プロゲステロン100mgを1日2~3回経口投与、または100mgを1日2~3回膣内投与、あるいは250mgを1日1回筋肉内投与し、10~12日間投与する。代替薬(卵巣過剰刺激症状がない場合):
- 黄体期の3.5日目と7日目に、ヒト絨毛性ゴナドトロピン1500~2500 IUを1日1回筋肉内注射する。
PCOSの治療に使用される他の薬剤:
- 抗アンドロゲン剤(例:スピロノラクトン、ロイプロリド、フィナステリド)。
- 低血糖薬(例:メトホルミン、インスリン)。
- 選択的エストロゲン受容体モジュレーター(例:クエン酸クロミフェン)。
- ニキビ治療薬(例:過酸化ベンゾイル、トレチノインクリーム(0.02~0.1%)/ゲル(0.01~0.1%)/溶液(0.05%)、アダパレンクリーム(0.1%)/ゲル(0.1%、0.3%)/溶液(0.1%)、エリスロマイシン2%、クリンダマイシン1%、スルフェタミドナトリウム10%)。
治療の副作用
クロミフェンを使用すると、ほとんどの患者で末梢性抗エストロゲン作用が発現します。これは、子宮内膜の成長が卵胞の成長より遅れ、頸管粘液の量が減少する現象です。ゴナドトロピン、特にヒト閉経期ゴナドトロピン(メノトロピン)を使用すると、卵巣過剰刺激症候群(OHSS)を発症する可能性があります。一方、遺伝子組換えFSH(フォリトロピンアルファ)を使用すると、卵巣過剰刺激症候群のリスクは低くなります。GnRHアゴニスト(トリプトレリン、ブセレリン、リュープロレリン)を含むレジメンを使用すると、卵巣過剰刺激症候群のリスクが高まり、GnRHアゴニストの使用は、ほてり、皮膚や粘膜の乾燥といったエストロゲン欠乏の症状を引き起こす可能性があります。
予測
多嚢胞性卵巣症候群における不妊治療の有効性は、病気の経過における臨床的およびホルモン的特徴、女性の年齢、準備療法の適切さ、および排卵誘発療法の正しい選択によって決まります。
病歴が短い若い女性の 30% では、排卵誘発なしで準備治療後に妊娠が可能です。
クロミフェンによる排卵刺激の有効性は女性一人当たり30%を超えず、多嚢胞性卵巣症候群の患者の40%はクロミフェンに抵抗性があります。
メノトロピンおよびウロフォリトロピンの使用により、女性の 45~50% が妊娠できますが、これらの薬剤は卵巣過剰刺激症候群を発症するリスクを高めます。
最も効果的なのはGnRHアゴニストを用いた計画であり、これにより「寄生的な」LHピーク(妊娠率の最大60%)を回避できます。しかし、これらの薬剤の使用には、重症の卵巣過剰刺激症候群、多胎妊娠といった合併症のリスクが最も高いことが知られています。GnRHアンタゴニストの使用も同等の効果がありますが、卵巣過剰刺激症候群の高リスクとは関連していません。
 [ 34 ]
[ 34 ]


