グッドパスチャー症候群は、血中の抗GBM抗体によって引き起こされる肺胞出血および糸球体腎炎を伴う自己免疫症候群です。グッドパスチャー症候群は、遺伝的素因を持つ喫煙者に最も多く発症しますが、炭化水素の吸入やウイルス性呼吸器感染症も原因となる可能性があります。グッドパスチャー症候群の症状には、呼吸困難、咳、倦怠感、喀血、血尿などがあります。喀血または血尿のある患者ではグッドパスチャー症候群が疑われ、血液中に抗GBM抗体が存在することで診断が確定します。グッドパスチャー症候群の治療には、血漿交換、グルココルチコイド、シクロホスファミドなどの免疫抑制剤などがあります。呼吸不全または腎不全を発症する前に治療を開始すれば、予後は良好です。
グッドパスチャー症候群は、1919年にグッドパスチャーによって初めて報告されました。グッドパスチャー症候群は、抗GBM抗体の存在下で糸球体腎炎と肺胞出血が併発する疾患です。グッドパスチャー症候群は、びまん性肺胞出血と糸球体腎炎の併発として最も多くみられますが、単独の糸球体腎炎(10~20%)や肺病変(10%)を呈することもあります。男性の方が女性よりも多く発症します。
グッドパスチャー症候群の原因は何ですか?
この疾患の原因は正確には特定されていません。グッドパスチャー症候群の遺伝的素因が推定されており、そのマーカーはHLA-DRW2の存在と考えられています。過去のウイルス感染(A型肝炎ウイルスやその他のウイルス性疾患)、産業災害、薬剤(主にD-ペニシラミン)が関与している可能性を示唆する見解もあります。
グッドパスチャー症候群の病態の根本原因は、腎臓および肺胞の糸球体毛細血管の基底膜に対する自己抗体の形成です。これらの抗体はIgGクラスに属し、補体C3成分の存在下で基底膜の抗体に結合し、腎臓および肺胞に免疫炎症を引き起こします。
抗GBM抗体は、IV型コラーゲンの3鎖の非コラーゲン性(NC-1)ドメインを標的としており、このドメインは腎臓および肺毛細血管の基底膜に最も高濃度で存在します。遺伝的素因を持つ人(ほとんどの場合、HLA-DRwl5、-DR4、および-DRB1アレルの保因者)では、環境因子(喫煙、ウイルス性急性呼吸器感染症、および炭化水素懸濁液の吸入(より一般的))および、まれに肺炎への曝露により、循環抗体に対する肺胞毛細血管抗原の提示が活性化されます。循環抗GBM抗体は基底膜に結合し、補体を固定し、細胞性炎症反応を誘発することで、糸球体腎炎および/または肺毛細血管炎の発症につながります。
腎臓と肺胞の糸球体毛細血管基底膜の自己抗原には、ある程度の共通性があると考えられます。自己抗原は、病因因子の損傷作用を受けて形成されます。未知の病因因子が腎臓と肺の基底膜を損傷し、その構造を変化させます。腎臓の糸球体基底膜が損傷すると、その分解産物の排泄が遅くなり、減少します。これは当然のことながら、腎臓と肺の自己免疫性障害の発生に必要な条件を整えます。基底膜のどの成分が自己抗原となるのかは、まだ完全には解明されていません。現在のところ、腎臓の糸球体基底膜の内部構造成分である4型コラーゲンのα3鎖が自己抗原となると考えられています。
形成された免疫複合体は糸球体毛細血管の基底膜に沿って沈着し、腎糸球体(糸球体腎炎)および肺胞(肺胞炎)における免疫炎症過程の発症につながります。この免疫炎症の発症に関与する主な細胞は、Tリンパ球、単球、内皮細胞、多形核白血球、肺胞マクロファージです。これらの細胞間の相互作用は、分子メディエーター、サイトカイン(増殖因子 - 血小板、インスリン様、β-トランスフォーミング、インターロイキン-1、腫瘍壊死因子など)によって促進されます。アラキドン酸代謝物、遊離酸素、タンパク質分解酵素、接着分子は、免疫炎症の発症において重要な役割を果たします。
グッドパスチャー症候群における肺胞炎の発症には、肺胞マクロファージの活性化が極めて重要です。活性化状態では、約40種類のサイトカインが分泌されます。グループIサイトカイン(ケモタキシン、ロイコトリエン、インターロイキン-8)は、多形核白血球の肺への流入を促進します。グループIIサイトカイン(増殖因子 - 血小板、マクロファージ)は、線維芽細胞の肺への移動を促進します。肺胞マクロファージはまた、活性酸素やプロテアーゼを産生し、肺組織に損傷を与えます。
グッドパスチャー症候群の病理形態学
グッドパスチャー症候群の主な病理形態学的症状は次のとおりです。
- 腎臓と肺の微小循環床への主な損傷。肺では、顕著な破壊と増殖を伴う細静脈炎、細動脈炎、毛細血管炎の所見が観察される。毛細血管の損傷は主に肺胞中隔で観察され、肺胞内に出血性滲出液を伴う肺胞炎が発生する。腎臓損傷は、毛細血管外増殖性糸球体腎炎の発症を特徴とし、それに続いて硝子化と線維化が生じ、腎不全の発症につながる。
- 顕著な肺胞内出血;
- 肺胞炎の進行の結果として、肺ヘモジデローシスおよび重症度の異なる肺硬化症が発症する。
グッドパスチャー症候群の症状
この疾患は、肺病変の臨床症状を呈することが最も多い。喀血が最も顕著な症状であるが、出血性症状がある場合でも喀血が認められない場合があり、胸部X線写真では浸潤性変化のみを呈する場合もあれば、浸潤と呼吸困難および/または呼吸不全を呈する場合もある。呼吸困難(主に労作時)、咳嗽、倦怠感、労働能力の低下、胸痛、発熱、体重減少がよくみられる。患者の最大40%に肉眼的血尿が認められるが、肺出血は腎症状の発現に数週間から数年先行することもある。
喀血中は息切れが悪化することがあります。また、脱力感や労働能力の低下も懸念されます。
グッドパスチャー症候群の症状は、聴診で肺が澄んでいる状態から、パチパチという音や乾いたラ音まで、時間の経過とともに変化します。貧血による末梢浮腫や蒼白がみられる患者もいます。
診察では、皮膚の蒼白、粘膜のチアノーゼ、顔面の蒼白または著しい腫脹、筋力の低下、体重減少に注意が向けられます。体温は通常、発熱レベルまで上昇します。
肺を打診すると、肺出血の広範囲にわたる病巣で打診音が短くなることが確認されることがあります。しかし、これはまれにしか観察されず、打診音に変化がない場合の方が多くあります。
グッドパスチャー症候群の特徴的な聴診所見は乾性喘鳴と湿性喘鳴であり、喀血中または喀血後にその数が著しく増加します。
心血管系を検査すると、動脈性高血圧が明らかになります。場合によっては、左心房の相対的鈍音境界の増大、心音の減弱、弱い収縮期雑音、そして重度の腎不全の進行に伴い心膜摩擦雑音が出現します。有意な動脈性高血圧を背景に腎障害が進行すると、心臓喘息と肺水腫の所見を伴う急性左室不全が生じることがあります。通常、この状態は病気の末期に発症します。
一般的に、腎障害は肺症状の発現から一定期間が経過した後に現れます。腎病変の特徴的な臨床症状は、血尿(肉眼的血尿の場合もある)、急速に進行する腎不全、乏尿、動脈性高血圧です。
症例の10~15%では、グッドパスチャー症候群は腎臓病理の臨床兆候から始まります。糸球体腎炎の臨床像(乏尿、浮腫、動脈性高血圧、著しい蒼白)が現れ、その後肺損傷の症状が加わります。多くの患者は筋肉痛や関節痛を呈することがあります。
発症の形態に関わらず、グッドパスチャー症候群はほとんどの場合重症で、病状は着実に進行し、重度の肺不全および腎不全を呈します。発症からの患者の平均余命は数ヶ月から1~3年です。最も多くは尿毒症または肺出血で死亡します。
グッドパスチャー症候群の診断
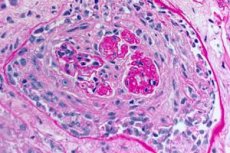
グッドパスチャー症候群の診断には、間接蛍光抗体法、または可能であれば組換えヒトNC-1 a3を用いた直接酵素結合免疫吸着測定(ELISA)による血清中の抗GBM抗体の検出が必要です。抗核抗体(ANA)検査などの血清学的検査はSLEの検出に用いられ、抗ストレプトリジンO抗体価は多くの肺腎症候群の原因となる連鎖球菌感染後糸球体腎炎の検出に用いられます。グッドパスチャー症候群の症例の25%はANCA(末梢血検体)陽性です。糸球体腎炎(血尿、タンパク尿、尿検査における赤血球泥、および/または腎不全)が存在する場合は、腎生検が適応となる場合があります。グッドパスチャー症候群およびその他の肺腎症候群の原因となる疾患の生検では、進行性病変を伴う急速進行性巣状壊死性糸球体腎炎が認められます。腎組織または肺組織の免疫蛍光染色では、典型的には糸球体または肺胞毛細血管に沿ったIgGの線状沈着が認められます。また、糖尿病性腎症および線維性糸球体腎炎(肺腎症候群を引き起こす稀な疾患)でも認められますが、これらの疾患におけるGBM抗体の検出は非特異的です。
肺機能検査と気管支肺胞洗浄はグッドパスチャー症候群の診断には役立ちませんが、糸球体腎炎と肺浸潤を伴うものの喀血のない患者において、びまん性肺胞出血の存在を確認するために用いられることがあります。複数回の洗浄後も洗浄液が出血性のままである場合、特にヘマトクリット値の低下が同時に認められる場合は、びまん性出血性症候群の診断確定につながる可能性があります。
 [ 3 ]
[ 3 ]
グッドパスチャー症候群の臨床診断
- 一般血液検査。特徴的な所見は、鉄欠乏性低色素性貧血、低色素、赤血球大小不同、赤血球奇形です。白血球増多、白血球組成の左方偏移、赤沈値の著しい上昇も認められます。
- 尿検査:尿中にタンパク質(タンパク尿の程度は顕著となる場合がある)、円筒状(顆粒状、硝子状、赤血球状)、赤血球(肉眼的血尿を呈する場合がある)が認められます。慢性腎不全が進行するにつれて、尿の比重は低下し、ジムニツキー試験では等低張尿が認められます。
- 血液生化学検査。血中尿素、クレアチニン、ハプトグロビン、セロムコイド、α2、γグロブリンの上昇、鉄含有量の減少。
- 免疫学的検査。Tリンパ球抑制因子数の減少が検出される場合があり、循環免疫複合体が検出されます。糸球体毛細血管および肺胞毛細血管の基底膜に対する抗体は、間接蛍光抗体法または放射免疫学的方法によって検出されます。
- 痰の分析。痰には多くの赤血球が含まれており、ヘモジデリン、シデロファージが検出されます。
グッドパスチャー症候群の機器診断
- 肺のX線検査。特徴的なX線所見は、肺の根元から肺の下部および中部に広がる浸潤影、および進行性で対称的な両側の雲状浸潤影です。
- 外呼吸機能の研究。スパイロメトリーでは拘束性呼吸不全(肺活量の低下)が明らかになりますが、病気が進行するにつれて閉塞性呼吸不全(FEV1の低下、ティフェノー指数の低下)が加わります。
- 心電図:貧血および低酸素性に起因する重度の心筋ジストロフィーの徴候が明らかになる(多くの誘導、特に左胸誘導においてT波振幅およびST間隔の減少)。重度の動脈性高血圧を伴う場合は、左室心筋肥大の徴候も現れる。
- 血液ガス分析により動脈性低酸素症が明らかになりました。
- 肺生検および腎臓生検の検査。非侵襲的な方法では正確な診断が不可能な場合、最終的な診断確定のために肺組織(開胸生検)および腎臓の生検が行われます。生検標本の組織学的および免疫学的検査が行われます。グッドパスチャー症候群の特徴的な徴候は以下のとおりです。
- 糸球体腎炎(ほとんどの場合毛細血管外)、出血性肺胞炎、ヘモジデローシスおよび間質線維症の形態学的徴候の存在。
- 免疫蛍光法を用いて肺胞と腎臓糸球体の基底膜上のIgGおよび補体成分C3の線状沈着を検出します。
グッドパスチャー症候群の診断基準
グッドパスチャー症候群の診断を行う際には、以下の基準を使用することをお勧めします。
- 肺病変と腎臓病変の組み合わせ、すなわち喀血(多くの場合肺出血)、息切れ、糸球体腎炎の症状。
- 呼吸不全および腎不全を伴い病気が着実に進行します。
- 鉄欠乏性貧血の発症。
- 肺のレントゲン検査中に、肺のパターンの網状変形を背景に、両側の複数の雲状浸潤が検出されました。
- 血液中に、腎臓の糸球体と肺胞の基底膜に対する高力価の循環抗体が検出されました。
- 糸球体および肺胞毛細血管の基底膜上の IgG および補体成分 C3 の線状沈着の検出。
- その他の全身症状(肺および腎臓を除く)がない。
グッドパスチャー症候群の鑑別診断
グッドパスチャー症候群は、喀血や肺出血を呈する多くの疾患と鑑別する必要があります。気管支および肺の腫瘍性疾患、結核、肺膿瘍、気管支拡張症、心臓血管疾患(肺循環のうっ血や高血圧につながる)、全身性血管炎、出血性素因を除外する必要があります。
グッドパスチャー症候群スクリーニングプログラム
- 一般的な血液検査と尿検査。
- 生化学的血液検査:総タンパク質およびタンパク質分画、クレアチニンおよび尿素、トランスアミナーゼ、血清粘液、ハプトグロビン、フィブリン、鉄の測定。
- 痰の分析:細胞学的検査、シデロファージの検出。
- 免疫学的研究:B リンパ球と T リンパ球の含有量、T リンパ球のサブポピュレーション、免疫グロブリン、循環免疫複合体、腎臓と肺胞の糸球体の基底膜に対する抗体の測定。
- 肺のX線検査。
- 心電図。
- スパイロメトリー。
- 肺と腎臓の生検の検査。
どのように調べる?
グッドパスチャー症候群の治療
グッドパスチャー症候群の治療には、抗 GBM 抗体を除去するための 2 ~ 3 週間の毎日または隔日の血漿交換 (4 L 血漿交換) が含まれます。これに、新しい抗体の形成を防ぐために 6 ~ 12 か月間、静脈内グルココルチコイド (通常はメチルプレドニゾロン 1 g を少なくとも 20 分かけて隔日で 3 回、プレドニゾロン 1 mg/kg 体重を 1 日 1 回投与) およびシクロホスファミド (2 mg/kg を 1 日 1 回) を併用します。肺機能および腎機能が改善しなくなったら、治療を漸減できます。長期死亡率は疾患発症時の腎機能障害の程度に関連します。早期に透析が必要になった患者および生検で半月体ネフロンが 50% 以上認められる患者の生存期間は 2 年未満であり、腎移植を考慮しない限り、透析が必要になることがよくあります。喀血は疾患の早期発見につながるため、予後良好の兆候である可能性があります。 ANCA陽性の患者のうち少数は、グッドパスチャー症候群の治療に良好な反応を示します。再発はごく一部の症例で発生し、喫煙の継続や呼吸器感染症と関連しています。末期腎疾患で腎移植を受けた患者では、移植腎において疾患が再発する可能性があります。
グッドパスチャー症候群の予後はどのようなものですか?
グッドパスチャー症候群は急速に進行することが多く、迅速に診断および治療しないと致命的となる可能性があります。呼吸不全または腎不全が発生する前に治療を開始した場合、予後は良好です。
肺出血および呼吸不全の発生時に直ちに生存するには、気道開存性を確保することが不可欠です。動脈血ガス濃度が境界値であり、呼吸不全が差し迫っている患者には、気管内挿管および機械的人工呼吸が推奨されます。


