統合失調症は、思考、感情、行動に影響を及ぼす重篤かつ慢性的な精神障害です。統合失調症の患者は、幻聴(幻聴)、せん妄(思考が支離滅裂または無意味になる)、時間や場所の混乱、認知障害など、様々な症状を経験することがあります。この障害は通常、成人期初期、特に青年期または若年成人期に発症します。
統合失調症の主な特徴は次のとおりです。
- 陽性症状: これらの症状には、幻聴や幻視、せん妄 (思考や会話が混乱すること)、妄想 (現実に基づかない信念)、思考障害などがあります。
- 陰性症状: 陰性症状には、無関心、社会からの引きこもり、無感情(喜びを体験できない)、失行(日常の作業を遂行する能力の低下)、言語障害などがあります。
- 混乱: 混乱には、思考の論理的順序を維持する能力と、正常な社会的機能および職業的機能の障害が伴います。
- 認知症状:記憶、注意、計画などの認知機能の障害です。
統合失調症の原因はまだ完全には解明されておらず、研究もされていませんが、遺伝的要因、脳内の神経化学物質の不均衡、ストレス、薬物、幼少期の暴露などの環境要因が含まれる可能性があると考えられています。
統合失調症の治療は、薬物療法(精神薬物療法)と心理社会的介入(心理療法、リハビリテーション、サポート)を組み合わせたものです。治療の目標は、症状の軽減、生活の質の向上、そして病気の管理です。早期発見と治療は、統合失調症の影響を軽減し、予後を改善するのに役立ちます。
疫学
2016年における統合失調症の世界年齢標準化有病率は0.28%(95% UI: 0.24~0.31)と推定され、統合失調症は思春期および若年成人期に発症し、40歳前後でピークに達し、それ以降の年齢層では有病率が低下することが示されています。有病率に男女差は認められませんでした。[ 4 ]
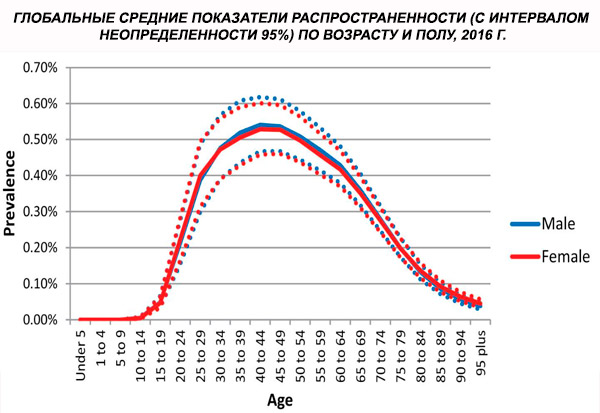
世界全体では、症例数は1990年の1,310万(95%CI:1,160~1,480万)から2016年の2,090万(95%CI:1,850~2,340万)に増加しました。年齢層は25~54歳です。
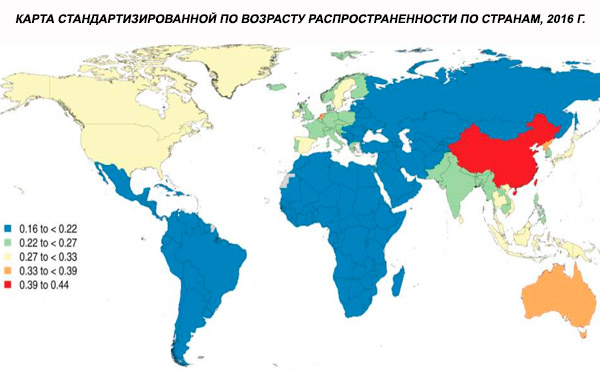
世界における統合失調症の有病率は約1%です。男女間で有病率はほぼ同程度であり、文化圏を超えて比較的一定しています。都市部では社会経済的に低い階層で有病率が高く、これは失業や貧困による身体機能の低下が原因と考えられます。同様に、孤独な人々の有病率が高いのは、統合失調症またはその前兆が社会生活に及ぼす影響を反映している可能性があります。発症の平均年齢は、男性で約18歳、女性で約25歳です。統合失調症は小児期に発症することは稀で、思春期初期や成人期後半に発症することがあります(パラフレニアと呼ばれることもあります)。
 [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
危険因子
向精神薬と現代の高感度神経化学的手法の出現により、中枢神経系の機能と精神障害との関連性を確立することが可能になりました。向精神薬の作用機序に関する研究により、精神病および統合失調症の病因における特定の神経伝達物質の役割について、多くの仮説が提唱されています。これらの仮説は、ドーパミン、ノルアドレナリン、セロトニン、アセチルコリン、グルタミン酸、いくつかのペプチド神経調節物質、および/またはそれらの受容体がこれらの障害の病因に関与していることを示唆しています。統合失調症におけるドーパミン仮説は、四半世紀以上にわたって有力な説であり続けています。
 [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
ドーパミン
コカイン、アンフェタミン、メチルフェニデートなどの精神刺激薬は、脳のドーパミン系を活性化します。これらの乱用は、統合失調症の陽性症状を想起させる妄想性精神病を引き起こす可能性があります。統合失調症患者において、精神刺激薬は精神病の増悪を引き起こす可能性があります。一方、定型神経遮断薬の作用はドーパミン受容体の遮断と関連しているという強力な証拠があります。第一に、ほとんどの定型神経遮断薬は錐体外路系の副作用を引き起こす可能性があり、これはドーパミンニューロンの死滅に伴って発現することがあります(例えば、パーキンソン病)。第二に、受容体結合研究により、定型神経遮断薬の臨床効果とドーパミンD2受容体への親和性との間に関連があることが明らかになっています。さらに、神経遮断薬の抗精神病作用は、ムスカリン受容体、αアドレナリン受容体、ヒスタミン受容体、セロトニン受容体といった他の受容体との相互作用に依存しないことが判明しました。これらの事実は、統合失調症の症状は、おそらく脳の皮質辺縁系にあるドーパミン受容体の過剰な刺激によって引き起こされるという仮説を裏付けています。[ 21 ]
しかし、統合失調症におけるドーパミン仮説の弱点は、ドーパミン受容体への影響が主に陽性症状にのみ影響し、陰性症状や認知障害にはほとんど影響を及ぼさないことです。さらに、ドーパミン系の機能評価において研究者間で異なる結果が得られたため、統合失調症におけるドーパミン伝達の根本的な欠陥を特定することはできませんでした。血液、尿、脳脊髄液中のドーパミンおよびその代謝物の濃度測定の結果は、これらの生物学的環境の規模が大きいため決定的なものではなく、統合失調症におけるドーパミン系の限定的な機能不全に関連する可能性のある変化を平準化していました。
統合失調症における尾状核のドーパミン受容体数の増加は、ドーパミン仮説の裏付けとも考えられるが、これらの変化の解釈は難しく、疾患の原因というよりは結果である可能性もある。[ 22 ] ドーパミン作動性システムの状態を評価するより有益な方法は、D2受容体と選択的に相互作用し、その結合能を測定できるリガンドを用いることである。薬剤投与前後の占有受容体数を比較することで、ドーパミンの放出と再取り込みの比率を推定することができる。この技術に基づく陽電子放出断層撮影(PET)を用いた最近の2つの研究は、統合失調症におけるドーパミン過剰作動性理論の真実性を示す最初の直接的証拠を提供した。[ 23 ]、[ 24 ]
死後解剖において脳組織中のドーパミンとその代謝物を測定することも重要であろう。しかし、死後細胞は崩壊するため、組織中の真のドーパミン濃度を決定することはしばしば困難である。さらに、抗精神病薬の投与も死後生化学検査の結果に影響を及ぼす可能性がある。これらの方法論的限界にもかかわらず、死後研究では統合失調症患者と対照群の脳において神経化学的な差異が明らかになっている。例えば、統合失調症患者の脳の死後解剖では、左扁桃体(大脳辺縁系の一部)におけるドーパミン濃度の上昇が明らかになっている。この所見は複数の研究で確認されており、変化が側性化しているためアーティファクトである可能性は低い。抗精神病薬療法を受けていない統合失調症患者の脳では、シナプス後ドーパミン受容体の増加も報告されている。これらのデータは、受容体数の増加が薬物療法の結果ではないことを裏付けている。さらに、患者が神経遮断薬を服用していたかどうかに関わらず、脳の特定の領域でドーパミン D4 受容体の数が増加しているという証拠があります。
しかし、ドーパミン仮説は、統合失調症の無活動性および無快楽性の症状の発現を説明できません。すでに述べたように、陰性症状の複合体は陽性症状とは比較的独立しているようです。ドーパミン受容体作動薬が陰性症状に好影響を与えるのに対し、受容体拮抗薬はヒトにおいて陰性症状の発現を促進し、実験動物において陰性症状をモデル化することは興味深いことです。したがって、前帯状皮質やその他の大脳辺縁系におけるドーパミンレベルの上昇は部分的に陽性精神病症状を引き起こす可能性がありますが、陰性症状は前頭前皮質におけるドーパミン系の活動低下の結果である可能性があります。おそらくこれが、脳の一部の領域におけるドーパミン機能亢進と他の領域における機能低下を同時に是正する抗精神病薬の開発が困難な理由です。
 [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
[ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
統合失調症発症におけるグルタミン酸仮説
グルタミン酸は脳内の主要な興奮性神経伝達物質です。統合失調症の病態におけるグルタミン酸の役割への関心は、グルタミン酸受容体の主要なサブタイプであるN-MemuA-D-acuapmame(NMDA)受容体複合体に関するデータから高まっています。脳内のグルタミン酸作動性、ドーパミン作動性、およびGABA作動性システムの相互作用に関する最近の研究では、フェンシクリジンを急性および慢性投与すると、NMDA受容体イオンチャネルを非競合的に遮断する精神異常誘発薬となることが示されています。フェンシクリジンの急性投与は、統合失調症の陽性症状、陰性症状、および認知症状に類似した作用を引き起こします。さらに、統合失調症患者における精神病の長期増悪に関する報告は、フェンシクリジンの精神異常誘発作用を裏付けています。フェンシクリジンの長期投与は、前頭前皮質におけるドーパミン作動性神経伝達の欠乏状態を引き起こし、これが陰性症状の発現に関与している可能性があります。さらに、フェンシクリジンとその類似体であるケタミンは、グルタミン酸作動性神経伝達を弱めます。フェンシクリジン乱用者における統合失調症様症状の観察は、健康な被験者を対象とした研究によって確認されており、ケタミンは統合失調症に特徴的な一過性の軽度の陽性症状、陰性症状、および認知症状を引き起こしました。フェンシクリジンと同様に、ケタミンは知覚の歪みを引き起こしました。このように、グルタミン酸作動性神経伝達の欠乏は、ドーパミン過剰状態と同様の症状を引き起こし、統合失調症の症状に類似しています。グルタミン酸作動性ニューロンは、NMDA受容体を介して(直接またはGABAニューロンを介して)ドーパミン作動性ニューロンの活動を抑制することができる。これは、グルタミン酸系と統合失調症におけるドーパミン理論との関連性を説明できる可能性がある。これらのデータは、統合失調症とグルタミン酸系の機能不全を関連付ける仮説を支持する。したがって、NMDA受容体複合体を活性化する化合物は統合失調症に有効である可能性がある。[ 32 ]、[ 33 ]
グルタミン酸系を刺激する薬剤の開発は、過剰なグルタミン酸活性が神経毒性作用を有することから困難です。しかしながら、グリシン自体またはD-シクロセリンによってグリシン部位を介したNMDA受容体複合体の活性化が統合失調症患者の陰性症状を軽減することが報告されており、これはグルタミン酸仮説の実用化の可能性を示す優れた例です。
グルタミン酸作動性仮説は、統合失調症における生化学的異常の研究における大きな進歩です。近年まで、統合失調症の神経化学的研究は、経験的に開発された神経遮断薬の作用機序の研究に限られていました。脳の神経組織と神経伝達物質の特性に関する知識の蓄積に伴い、まず病態生理学的理論を構築し、それに基づいて新薬を開発することが可能になりました。現在、統合失調症の起源に関する様々な仮説が提唱されていることから、将来的には新薬開発がより迅速に進むことが期待されます。
統合失調症の発症に関するその他の神経伝達物質および神経調節仮説
前頭皮質と大脳辺縁系の豊富なセロトニン神経支配、脳のセロトニン系がドーパミンニューロンの活動を調節し、広範囲の複雑な機能の調節に関与する能力があることから、多くの研究者が、統合失調症の発症にセロトニンが重要な役割を果たしていると結論づけています。特に興味深いのは、過剰なセロトニンが陽性症状と陰性症状の両方を引き起こす可能性があるという仮説です。[ 34 ] この理論は、セロトニン受容体を遮断するクロザピンなどの新世代神経遮断薬が、典型的な神経遮断薬に抵抗性のある慢性疾患患者の陽性症状を抑制する能力と一致しています。しかし、多くの研究で、セロトニン受容体拮抗薬が精神病、うつ病、または薬物療法の副作用に関連する陰性症状を軽減する能力については疑問が投げかけられています。これらの薬剤は、統合失調症の根本的な欠陥である主要な陰性症状の治療薬として正式に承認されていません。しかしながら、セロトニン受容体拮抗薬(特に5-HT2a)が有効である可能性があるという考えは、新世代の神経遮断薬の開発に大きな役割を果たしてきました。D2/5-HT2受容体拮抗薬の併用による利点は、抗精神病薬としての作用の高さよりも、錐体外路系の副作用の発現率が低いことにあると考えられます。しかし、これによりコンプライアンス(患者の協力意欲)が向上するため、治療効果はより高まります。
統合失調症におけるノルアドレナリン系の機能不全の重要性についても仮説が立てられています。統合失調症の最も特徴的な症状の一つである無快感症は、満足感や快感を得ることができない状態であり、その他の欠乏症状はノルアドレナリン強化系の機能不全に関連している可能性があると考えられています。しかし、この仮説を検証する生化学的および薬理学的研究の結果は矛盾していることが判明しています。ドーパミン仮説やセロトニン仮説の場合と同様に、統合失調症ではノルアドレナリン系の活動の低下と亢進の両方が起こり得ると考えられています。
統合失調症の発症に関する一般的な仮説
統合失調症の今後の研究は、神経解剖学的および神経化学的仮説を統合した複雑なモデルによって導かれる可能性が高い。そのようなアプローチの一例としては、皮質、基底核、視床(皮質下-視床皮質神経回路を形成する)間の接続を遮断する神経伝達物質系の役割を考慮した理論がある。大脳皮質は、基底核へのグルタミン酸作動性投射を介して、特定の行動の実行を促進し、他の行動を抑制する。[ 35 ] グルタミン酸作動性ニューロンは、介在するGABA作動性ニューロンとコリン作動性ニューロンを刺激し、これがドーパミン作動性ニューロンなどのニューロンの活動を抑制します。このモデルで検討された皮質-皮質下回路の神経解剖学的および神経化学的メカニズムの研究は、統合失調症の発症機序に関する新しい仮説を生み出す出発点となった。これらのモデルは、新薬の神経伝達物質ターゲットの探索を容易にし、また、統合失調症におけるフェンサイクリジンなどの既存薬の作用の特徴の一部を説明します。
キナンとリーバーマン(1996)は、従来の抗精神病薬(ハロペリドールなど)と比較した非定型抗精神病薬(クロザピンなど)の独特な作用を説明するために、最新の神経解剖学的モデルを提唱した。このモデルによると、クロザピンの独特な作用は、定型抗精神病薬が線条体の機能に有意な影響を及ぼすのに対し、線条体のニューロンの活動には影響を与えずに、大脳辺縁系に非常に特異的に作用するという事実によって説明される。同様の特性を持つ他の抗精神病薬(オランザピンなど)も、従来の抗精神病薬より優れている可能性がある。新しい抗精神病薬(リスペリドンやセルチンドールなど)は、クロザピンほど大脳辺縁系に限定されませんが、治療量で神経障害を引き起こす可能性が低いという点で、定型抗精神病薬に匹敵する。薬理学的および臨床的に同様の作用を持つ新しい薬剤が利用可能になるにつれて、この仮説やその他の仮説の妥当性に関する研究は継続される。
病因
統合失調症の患者には特定の薬剤群が処方されますが、薬剤の選択は診断よりも患者の症状とその組み合わせの性質によって決定されることが多いです。
知覚の歪みと行動の混乱は異なる症状ですが、どちらもドパミンD2受容体拮抗薬という同じ薬剤に反応します。[ 36 ]、[ 37 ] このことから、抗精神病薬療法を検討する際には、これら2つの症状複合体を併せて考慮することが正当化されます。
統合失調症における陰性症状の発現メカニズムは、前頭前皮質のドパミン作動系の活動低下と関連しており、精神病の根底にあると考えられる大脳辺縁系の機能亢進とは関連していない。この点で、精神病を抑制する薬が陰性症状を増悪させるのではないかという懸念が生じる。[ 38 ]、[ 39 ]、[ 40 ] 同時に、ドパミン受容体作動薬は陰性症状を弱める一方で、陽性症状を誘発することがある。陰性症状は統合失調症の重要な症状の一つであり、情動意志領域の持続的な障害を特徴とする。これまでのところ、この疾患の最も重要な症状を明らかに軽減できる薬剤は存在しない。しかし、非定型抗精神病薬の臨床試験では、評価尺度を用いて評価した陰性症状の重症度を軽減できることが示されている。 SANS、BPRS、PANSSの各尺度には、学校や職場での活動、社会的な接触の制限、感情的な分離を評価する項目が含まれています。これらの症状は、精神病の症状が弱まるにつれて軽減する、疾患の一般的な兆候とみなすことができますが、神経遮断薬の副作用(例えば、動作緩慢や鎮静作用)やうつ病(例えば、無快感症)と関連する場合もあります。したがって、神経遮断薬療法を背景に顕著な妄想性障害を呈する患者は、妄想性症状が退行するにつれて、より社交的になり、警戒心が薄れ、感情的な反応がより活発になる可能性があります。しかし、これらすべては、一次的な情動意志障害の軽減ではなく、二次的な陰性症状の弱まりとして捉えるべきです。
注意力や情報処理能力を評価し、神経解剖学的解釈を伴う多くの神経心理学的検査は、統合失調症患者の変化を明らかにする。統合失調症患者の認知障害は、疾患の主要症状とは直接関連しておらず、精神病症状が著しく退行しても通常は安定している。[ 41 ]、[ 42 ] 認知障害は、一次性陰性症状とともに、持続的な不適応や生活の質の低下の重要な原因の一つであると考えられる。典型的な神経遮断薬は精神病症状を効果的に抑制し、再発を防ぐ能力があるにもかかわらず、疾患のこれらの中核症状に対する効果がないため、患者の障害レベルがこれほど高いことが説明できるかもしれない。
 [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ], [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ]
[ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ], [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ]
症状 統合失調症
統合失調症を単一の疾患として捉える概念は、20世紀初頭にエミール・クレペリンが妄想、喘息、緊張病はそれぞれ別個の疾患ではなく、早発性痴呆の兆候であると示唆したことで生まれました。彼はまた、この精神疾患と躁うつ病を明確に区別しました。これは、多くの精神疾患が梅毒と関連付けられ、他の精神疾患患者群と区別することが可能になったことで可能になりました。神経梅毒の病因、治療法、そして予防法の発見は、医学における大きな成果の一つであり、主要な精神疾患の原因解明への希望を与えました。
オイゲン・ブロイラー(1950)は、それまで用いられていた「早発性痴呆」に代えて「統合失調症」という新しい用語を提唱し、この疾患の根本的な精神病理学的特徴は、思考過程「内」と思考と感情の間の双方における解離(「分裂」)であると主張しました。「統合失調症」という用語はこの概念を表現したものであり、その後の発展に大きな影響を与えました。後に統合失調感情型と潜在型が追加された古典的な統合失調症(例えば、暴動性、妄想性、緊張性、単純性)は、臨床現場では記述的な目的で現在も広く診断されていますが、近年では米国の公式命名法であるDSM-IIIおよびDSM-IVの影響を受けて、精神医学用語が変化する傾向にあります。しかし、統合失調症の個々の形態を識別することは、差別化された治療法の開発や病因および発症の研究という点では非生産的であることが判明しています。
ICD-10 には、統合失調症の次のような症状が挙げられています:妄想(奇異、誇大、または被害妄想)、思考障害(断続的または非論理的な思考の流れ、または理解不能な発話)、知覚障害(幻覚、受動感覚、関係観念)、気分障害、運動障害(緊張病、興奮、昏迷)、人格衰退、機能低下。
生涯を通じて、統合失調症を発症する割合は0.28%(95% UI: 0.24~0.31)です。小児期には、統合失調症の症状として、意欲と情動反応の減退が見られます。その後、現実感覚が損なわれ、知覚と思考が特定の文化における規範から大きく逸脱し、妄想や幻聴といった形で現れることがよくあります。幻視や幻体、思考や行動の混乱もよく見られます。
現実感覚の障害を伴う精神病は、通常、男性では17〜30歳、女性では20〜40歳に発症します。精神病の経過と結果は非常に多様です。一部の患者(約15〜25%)では、最初の精神病エピソードが完全に寛解し、その後5年間は精神病症状が認められません(ただし、その後の観察期間中、これらの患者の割合は減少します)。他の患者(約5〜10%)では、顕著な精神病症状が寛解せずに長年持続します。ほとんどの患者では、最初の精神病エピソードの後、部分的な寛解が起こり、その後、精神病症状の増悪が定期的に観察されます。
一般的に、精神病の重症度は最初のエピソードから5~10年でプラトーに達するが、情緒的・意志的な貧困はより長期間続く。[ 53 ] 統合失調症の症状の進行は、統合失調症に伴う一次性障害の増加の結果であることが多い。これらには、自閉症、労働能力の喪失、学習障害、自尊心および他者の自尊心の低下などがある。その結果、患者は孤立し、仕事を見つけられず、ストレスにさらされ、それが症状の悪化や機能障害の増大を誘発する可能性がある。さらに、統合失調症の診断自体が他の人々の間で否定的な反応を引き起こし続け、患者の能力をさらに制限する。加齢とともに統合失調症の症状は弱まり、機能状態はしばしば改善する傾向があるが、患者が失った人生年数や逃した機会を補うことはできない。
犯罪行為と統合失調症の関係
ウェスリーらは、カンバーウェル・レジスターの研究において、「統合失調症は犯罪リスクと犯罪頻度の増加と関連しているのか?」という疑問に答えようとした。彼らは、統合失調症患者は一般的に犯罪リスクが高いとは考えられていないものの、他の精神疾患患者よりも暴力犯罪で有罪判決を受けるリスクが高いと結論付けた。精神病患者は暴力行為のリスクが高く、したがって暴力犯罪で有罪判決を受けるリスクも高かったが、併存する薬物乱用がない場合、この関連性は明確ではなかった。英国国家統計局による受刑者の精神疾患罹患率の調査では、研究対象年における機能性精神病の有病率は、有罪判決を受けた男性で7%、無罪の勾留中の男性で10%、女性受刑者で14%であった。一方、一般人口における同程度の数値は0.4%であった。このレビューの結果は、上記の結果の再検討を必要とする可能性があります。なぜなら、この規模の刑務所と一般受刑者との間の精神疾患発生率の差が、精神疾患患者に対する裁判所の判決偏重によって説明できる可能性は極めて低いからです。もちろん、これらの結果は犯罪と精神疾患の因果関係を示唆するものではなく、関連性のみを示唆しています。
統合失調症と暴力犯罪との関連は、統合失調症と他の犯罪との関連よりも、一般的に多くの注目を集めてきた。[ 54 ]、[ 55 ] このテーマに関する研究のテイラーのレビューでは、統合失調症患者が暴力犯罪で有罪判決を受けた場合、暴力行為は圧倒的に病気の発症後に起こると結論付けている。初回エピソード統合失調症の研究では、初回エピソード患者の3分の1以上が入院前1か月間に、生命を脅かす可能性のある行動や奇妙な性行動などの暴力行為に従事していたことが示されている。これらの患者の多くは初回入院前に警察と接触していたが、入院後に告発された患者はほとんどいなかった。テイラーは、ブリクストン刑務所の拘留囚人の連続サンプルで統合失調症の可能性を調査した。統合失調症患者の暴力犯罪での有罪判決の発生率は約12%から13%であった。対照群の約5%から8%が暴力犯罪で有罪判決を受けました。精神疾患を持つ人々による殺人事件に関する全国秘密調査の報告書によると、殺人で有罪判決を受けた者の5%に精神病の症状が見られました。精神病を持つ人々に関する一般的な考えとは異なり、被害者はほとんどの場合、見知らぬ人ではなく家族です(これは、Steadmanらの研究における地域サンプルの暴力行動に関するより一般的な知見です)。
統合失調症の特定の症状の中には、暴力と関連しているものがあります。例えば、フィンランドで重度の暴力行為を起こした統合失調症患者のグループと放火犯のグループを研究したヴィルクネンは、患者の3分の1が幻覚や妄想に直接起因して犯罪を犯し、残りの3分の2は家庭内のストレスに起因する問題が原因で犯罪を犯したことを発見しました。脅威や状況に対する制御の喪失の症状は、暴力と直接関連しています。個人の自律性や状況に影響を与える能力を破壊する症状を持つ患者は、自分に関連する脅威に対抗するための行動を正当化できると考えることがあります(「非合理性の中の合理性」)。
妄想性精神病患者は、自身の考えの結果として暴力行為に及ぶ場合、非暴力性精神病患者とは異なり、自身の考えを裏付ける証拠への執着、そのような証拠が発見されたという確信、そして妄想的な執着に関連する感情的変化(特に抑うつ、怒り、恐怖)において異なる。テイラーらによるブリクストンの研究では、受動性妄想、宗教妄想、影響妄想が暴力行為と有意に関連が高かった。
統合失調症の活動性症状(脅威症状や制御喪失症状を含む)に関連するリスクは、薬物乱用によって大幅に増大します。後者の要因の役割は、Steadmanらによる研究で強調されています。この要因を除外した場合、最近退院した精神科患者の暴力率は、一般人口の暴力率と同程度でした。疾患に伴う幻覚は、命令幻覚、または誤って知覚された味覚や嗅覚が制御妄想の「証拠」と解釈される場合に、暴力と最もよく関連付けられます。統合失調症患者の犯罪における異常な人格発達の役割(併存疾患であるか、疾患の結果であるかを問わず)については、あまりよく理解されていません。
 [ 56 ], [ 57 ], [ 58 ], [ 59 ]
[ 56 ], [ 57 ], [ 58 ], [ 59 ]
統合失調症の症状に関する理論
統合失調症は早期に発症し、着実に進行する神経変性疾患(早発性痴呆)であるという当初の概念は現在では否定されている。現代の仮説では、統合失調症は神経系の発達障害を伴う神経発達疾患であり、最初の数年間のみ進行し、生涯にわたって進行するものではないと考えられており、これは臨床観察とより一致している。[ 60 ]、[ 61 ]統合失調症の異発生理論により、確立された病因の役割を理解することができる。統合失調症の危険因子、例えば冬季出産、家族歴の陽性、複雑な妊娠および出産は、脳の発達を妨げ、早期に疾患の素因を形成する可能性がある。遺伝的素因を持つ子供、例えば統合失調症を患う母親から生まれた子供を観察すると、運動障害、認知障害、情動障害の存在とその後の精神病の発症との間に関連があることが明らかになっている。精神病は、小児期および青年期に病状が進行した結果なのか、それとも幼少期に発症し安定していた素因が、心理的ストレスが増大する青年期に顕在化することで発症するのかについては議論がある。これらの説は互いに矛盾するものではなく、いずれも軽度の症状が早期に現れ、その後本格的な精神病へと発展することを示唆している。ただし、疾患が精神病レベルに達した後は、神経画像診断法、神経心理学的研究、臨床観察、そして最終的には病理形態学的データによっても、疾患のさらなる進行は示されないことに留意すべきである。
統合失調症患者の多くは生涯を通じて陰性症状を抱え続け、社会不適応の増加は患者と社会との関係性の結果であると考えられる。[ 62 ] これは、たとえば雇用の問題を考えれば、ごく基本的なレベルで説明できる。精神病エピソードの後、患者が以前の生活や職業に戻ることは困難である。症状がまったくない場合でも、雇用主、同僚、友人、親戚は患者を有能な人物とみなさない。統合失調症患者の失業率は80%に達するが、患者のかなりの割合が就労能力を保持している。この要因の重要性は、発展途上国の社会中心主義文化の研究でよく実証されている。そこでは、統合失調症患者はストレスのはるかに少ない環境で社会的、職業的地位を維持することができる。これらの国では、この病気の経過はより穏やかである。統合失調症の病因と神経生物学的基礎に関する詳細な議論は、Carpenter と Вuchanan、Waddington によって提供されています。
統合失調症患者は、発症の性質、主症状、経過、治療の有効性、および転帰に関して非常に多様であることが長い間指摘されてきました。 1974年に、横断的かつ長期の臨床観察のデータに基づいて、陽性精神病症状、陰性症状、および対人関係の崩壊が相対的に独立していることを示す代替仮説が提唱されました (Strauss et al., 1974)。 この仮説の本質は、これらの症状群は独立した精神病理学的基礎を持ち、単一の病態生理学的プロセスの発現を示すものではないというものです。 [ 63 ] 観察期間中、1つのグループに関連する精神病理学的症状の重症度の間には高い相関が認められ、逆に、異なるグループに関連する症状の重症度の間には相関は見られませんでした。 これらのデータは多数の研究で確認されましたが、1つの追加研究がありました。幻覚と妄想は互いに密接に関連しているものの、他の陽性症状(例えば、思考や行動の混乱)とは相関関係がないことが判明しました。現在、統合失調症の主な症状としては、現実感覚の歪み、思考や行動の混乱、陰性症状、認知障害が一般的に認められています。統合失調症の陰性症状には、感情反応とその外的表出の弱化、言語能力の低下、社会参加意欲の低下などが挙げられます。クレペリンは以前、これらの症状を「意志の源泉の枯渇」と表現していました。症状群間の差異は、薬物療法を処方する際に非常に重要です。治療の観点から重要なその他の臨床症状としては、抑うつ、不安、攻撃性、敵意、自殺行動などが挙げられます。
長年にわたり、統合失調症における薬物療法の効果は、主に精神病症状や入院期間、寛解期間などの関連パラメータへの影響によって評価されてきました。しかし、各症状群の相対的な独立性が認識されるにつれ、各症状群に対する治療効果の包括的な評価が標準となっています。標準的な抗精神病薬療法は、統合失調症の認知障害と陰性症状にはほとんど効果がないことが判明しました。[ 64 ] 一方、これら2つの症状群は、患者の病状の重症度と生活の質に決定的な影響を及ぼす可能性があります。従来の薬物療法の限界が認識されたことが、統合失調症のこれらの症状に対する治療薬の開発の原動力となっています。
統合失調症は、数回の増悪を経て進行する慢性疾患ですが、増悪の期間と特徴はさまざまです。統合失調症の患者は、治療を求める12~24か月前に精神病症状を呈する傾向があります。病前期には、正常または障害のある社会的能力、軽度の認知の混乱または知覚の歪み、快楽を経験する能力の低下(無快感症)、およびその他の一般的な対処困難が含まれます。統合失調症のこのような症状は、微妙で後になって初めて認識される場合もあれば、社会的、学業的、職業的機能の障害によってより顕著になる場合もあります。前駆期には、引きこもりまたは孤立、易刺激性、疑い深さ、異常な思考、知覚の歪み、混乱などの無臨床症状が現れることがあります。病気の発症(妄想および幻覚)は、突然(数日または数週間)またはゆっくりと徐々に(数年かけて)起こる場合があります。統合失調症の経過は、エピソード性(明らかな増悪と寛解を繰り返す)の場合もあれば、持続性の場合もあり、機能障害は悪化する傾向があります。病気の後期には、病状のパターンが安定し、障害の程度が安定し、さらには軽減することもあります。
一般的に、統合失調症の症状は、陽性症状、陰性症状、認知症状、そして解体症状に分類されます。陽性症状は正常機能の過剰または歪みを特徴とし、陰性症状は正常機能の低下または喪失を特徴とします。解体症状には、思考障害や不適切な行動が含まれます。認知症状は、情報処理障害や問題解決の困難さです。臨床像には、これらのカテゴリーのいずれか、またはすべての症状が現れる場合があります。
統合失調症の陽性症状は、妄想と幻覚、つまり思考の障害と不適切な行動に分けられます。妄想とは誤った信念です。迫害妄想では、患者は自分が悩まされている、尾行されている、または騙されていると信じます。関係妄想では、患者は書籍、新聞、歌詞などの外的手がかりが自分に関連していると信じます。思考挿入妄想または思考撤退妄想では、患者は他人が自分の心を読める、自分の思考が他人によって伝達される、または思考や衝動が外部の力によって自分に植え付けられると信じます。幻覚には、聴覚、視覚、嗅覚、味覚、触覚などがありますが、最も一般的なのは幻聴です。患者は、自分の行動についてコメントしたり、互いに話したり、批判的または侮辱的な発言をしている声が聞こえることがあります。妄想と幻覚は、患者にとって非常に苦痛となる可能性があります。 [ 65 ]
思考障害には、支離滅裂で無目的な発話を伴う、まとまりのない思考や、話題が次から次へと移り変わることが含まれます。発話障害は、軽度の支離滅裂から支離滅裂で意味不明な発話まで様々です。不適切な行動には、子供のような愚かさ、興奮、不適切な外見や癖などが含まれます。緊張病は、行動障害の極端な形態であり、硬直した姿勢を維持し、動きや目的のない自発的な運動に対して持続的に抵抗するなどが含まれます。
この病気の陰性(欠陥)症状は、感情の平坦化、言語能力の低下、無快感症、非社交性といった形で現れます。感情の平坦化がみられると、患者の表情は表情筋が萎縮し、アイコンタクトが乏しく、表情が乏しくなります。言語能力の低下は、発話量の減少、質問に対する単音節の返答といった形で現れ、内面的な空虚感を生み出します。無快感症は、活動への関心の低下と、目的のない活動の増加を反映している可能性があります。非社交性は、人間関係への関心の低下として現れます。陰性症状は、しばしば意欲の低下や行動の目的意識の低下につながります。
認知障害には、注意力、言語処理能力、作業記憶、抽象的思考、問題解決能力、社会的交流の理解能力などが含まれます。患者の思考は硬直化し、問題解決能力、他者の視点の理解能力、経験からの学習能力が低下します。統合失調症の症状は、典型的には日常生活を営む能力を低下させ、仕事、社会関係、そしてセルフケアに著しい支障をきたします。失業、孤立、人間関係の崩壊、生活の質の低下などがよく見られます。認知障害の重症度は、全体的な障害の程度を大きく左右します。
自殺
研究によると、統合失調症患者の少なくとも5~13%が自殺で亡くなっている。[ 66 ] 自殺は統合失調症患者の早期死亡の主な原因であり、これが統合失調症患者の平均寿命が平均10年短い理由の一部を説明する可能性がある。妄想型統合失調症患者は、発症が遅く、発病前の機能が良好で回復の予後が最も良好であるにもかかわらず、自殺する可能性が高い。これらの患者は悲しみや苦悩を経験する能力を保持しているため、病気の結果を現実的に理解した上で、絶望的な行動をとる可能性が高いと考えられる。
暴力
統合失調症は、暴力行為の比較的軽微な危険因子である。本当に危険な行為よりも、暴力の脅迫や軽度の攻撃的な爆発の方がはるかに一般的である。暴力行為を起こす可能性が高い患者には、薬物やアルコールを乱用している人、迫害妄想や命令幻覚がある人、処方された治療を受けていない人などが含まれる。非常にまれではあるが、孤立感を感じている重度のうつ病妄想性患者は、自分の問題の唯一の原因であると認識している人(権威者、有名人、配偶者など)を攻撃したり、殺害したりする。ほとんどの統合失調症患者は決して暴力的にならない。殺人を犯す統合失調症患者1人に対して、100人が自殺する。[ 67 ] 統合失調症患者は、暴力の脅迫や食料、避難所、必要なケアを得るために救急外来を受診することがある。
フォーム
統合失調症には、妄想型、解体型、緊張型、残遺型、未分化型の5つの形態が知られています。妄想型統合失調症は、認知機能と感情は正常で、妄想と幻聴が特徴的です。解体型統合失調症は、言語と行動の混乱、そして平坦または不適切な感情が特徴的です。緊張型統合失調症では、身体症状が優勢で、動けない、または過剰な運動活動、奇妙な姿勢をとるなどの症状が見られます。未分化型統合失調症では、症状は複雑に混在しています。残遺型統合失調症では、統合失調症の明確な既往歴があり、より顕著な症状が現れた後、中等度の陰性症状が長期間続きます。
一方、一部の専門家は、感情の平坦化、動機づけの不足、目標指向性の低下といった陰性症状の有無と重症度に基づき、統合失調症を欠陥型と非欠陥型の2つのサブタイプに分類しています。欠陥型の患者は、他の要因(抑うつ、不安、環境刺激の不足、薬剤の副作用など)を考慮に入れず、陰性症状に支配されます。非欠陥型の患者は、妄想、幻覚、思考障害を示す場合がありますが、陰性症状はほとんど見られません。
診断 統合失調症
統合失調症を診断するための特別な検査はありません。診断は、患者の病歴、症状、および徴候の包括的な評価に基づいています。[ 76 ] 家族、友人、教師、同僚などの追加情報源からの情報が役立つことがよくあります。精神障害の診断と統計のマニュアル第4版(DSM-IV)によると、診断には、1ヶ月間の大部分の時間に2つ以上の特徴的症状(妄想、幻覚、支離滅裂な言語、支離滅裂な行動、陰性症状)がみられること、および前駆症状または社会的、職業的、およびセルフケアの障害を伴う微小症状が、1ヶ月間の顕性症状を含む6ヶ月間にわたって明らかであることが必要です。
他の疾患や薬物乱用による精神病の可能性は、患者の病歴、臨床検査、神経画像検査などの検査結果を検討することで除外する必要があります。統合失調症患者の一部には脳の構造的異常が認められますが、診断に十分なほど特異的ではありません。
統合失調症に類似した症状を示す他の精神疾患には、一過性精神病性障害、統合失調症様障害、統合失調感情障害、妄想性障害などがあります。さらに、気分障害も一部の人に精神病を引き起こすことがあります。一部のパーソナリティ障害(特に統合失調型)は統合失調症に類似した症状を呈しますが、通常はより軽度で精神病的ではありません。
精神病を発症した場合、まず最初にすべきことは原因の特定です。原因が分かれば、より的確な治療と予防が可能になります。正確な診断が効果的な治療の鍵となることは、妄想症状の例からも明らかです。妄想症状は、統合失調症だけでなく、一時性てんかん、アンフェタミン依存症、そして躁病期の感情障害にも見られる症状です。これらの症例にはそれぞれ特別な治療が必要です。
差動診断
統合失調症の鑑別診断アルゴリズムは、米国精神医学会の精神障害の診断と統計マニュアル第4版(DSM-IV)に記載されています。このアルゴリズムによれば、精神病患者においては、まず身体疾患と薬物乱用を除外する必要があります。次に、症状が情動障害によって引き起こされているかどうかを判断します。情動障害でない場合は、臨床像に応じて統合失調症または統合失調型障害と診断されます。様々な原因による精神病性障害の治療にはそれぞれ特徴がありますが、原則としてすべての症例において神経遮断薬が使用されます。
 [ 81 ], [ 82 ], [ 83 ], [ 84 ], [ 85 ], [ 86 ], [ 87 ], [ 88 ], [ 89 ], [ 90 ]
[ 81 ], [ 82 ], [ 83 ], [ 84 ], [ 85 ], [ 86 ], [ 87 ], [ 88 ], [ 89 ], [ 90 ]
連絡先
処理 統合失調症
統合失調症は、精神科治療への紹介を必要とする病態です。そして、ここでは精神病的体験と犯した犯罪との間に直接的な関連がある必要は全くありません。対象者が病気であることだけで十分です。一般的に、実践が証明しているように、犯罪が陽性精神病症状と関連していない場合、それは病気の結果として患者の人格の低下と関連しています。もちろん、犯罪が人生の犯罪パターンの一部であり、たまたま統合失調症を発症したという人もいますが、一般的には、現在精神科治療を必要としている人には、そのような治療が提供されるべきです。しかし、特に満足のいく入院サービスがない場合、必ずしもそうとは限りません。対象者が完全寛解状態にある間に犯罪を犯し、それが彼の犯罪歴の一部である場合、対象者はその行為に責任を負います。統合失調症は非常に重篤な場合があり、対象者は裁判に参加できないと判断されることもあります。この病気は殺人事件における責任軽減の根拠となり、マクノートンルールの適用根拠となり得る。
精神病症状の発現から治療開始までの時間は、初期の治療反応の速さ、治療反応の質、そして陰性症状の重症度と相関関係にあります。早期治療は通常、より迅速かつ完全な反応をもたらします。初回エピソード中に治療を受けない場合、患者の70~80%は12ヶ月以内に再発します。抗精神病薬を長期使用することで、1年間で再発率を約30%低下させることができます。
治療の主な目標は、精神病症状の重症度を軽減し、症状の悪化や関連する機能障害を予防し、患者が可能な限り高いレベルで機能できるよう支援することです。抗精神病薬、地域リハビリテーション、そして心理療法が治療の主要な構成要素です。統合失調症は長期にわたる再発性の疾患であるため、患者に自助スキルを指導することは治療の重要な目標です。
特定の神経伝達物質受容体への親和性と活性に基づき、薬剤は定型抗精神病薬(神経遮断薬)と第二世代抗精神病薬(SGA)に分類されます。SGAには、効力がやや高い(ただし、一部のSGAではこれらの利点については議論の余地があります)ことや、多動性障害などの副作用の発生率が低いことなど、一定の利点があります。
伝統的な抗精神病薬による統合失調症の治療
これらの薬剤の作用機序は、主にドーパミンD2受容体(ドーパミン2遮断薬)の遮断に関連しています。従来の抗精神病薬は、高力価、中力価、低力価に分類されます。高力価抗精神病薬はドーパミン受容体への親和性が高く、アドレナリン受容体およびムスカリン受容体への親和性は低くなります。低力価抗精神病薬はほとんど使用されませんが、ドーパミン受容体への親和性は低く、アドレナリン受容体、ムスカリン受容体、ヒスタミン受容体への親和性は比較的高くなります。これらの薬剤は、錠剤、液剤、短時間作用型、長時間作用型の筋肉内注射剤など、様々な形で提供されています。薬剤の選択は、主に副作用プロファイル、投与経路、および患者の過去の薬剤に対する反応に基づいて行われます。[ 91 ]
伝統的な抗精神病薬
クラス |
準備(境界) |
1日摂取量 |
平均線量 |
コメント |
脂肪族フェノチアジン |
クロルプロマジン |
30~800 |
就寝前に400mgを経口投与 |
低効力薬の原型。直腸坐剤にも使用される。 |
ピペリジン |
チオリダジン |
150~800 |
就寝前に400mgを経口投与 |
絶対最大用量(800mg/日)が定められている唯一の薬剤です。高用量では網膜色素変性症を引き起こし、顕著な抗コリン作用を示します。QTk延長に関する追加の警告が添付文書に記載されています。 |
ジベンゾオキサゼピン |
ロキサピン |
20~250 |
就寝前に60mgを経口投与 |
ドーパミンD受容体およびセロトニン5HT受容体に親和性がある |
ジヒドロインドロン |
モリンドン |
15-225 |
就寝前に60mgを経口投与 |
体重減少を引き起こす可能性があります |
チオキサンテン |
チオチキセン |
8-60 |
就寝前に10mgを経口投与 |
アカシジアの発生率が高い |
ブチロフェノン |
ハロペリドール |
1-15 |
就寝前に経口で4mg |
高効力薬剤のプロトタイプ。ハロペリドールデカノエート(筋注デポ剤)が利用可能。アカシジアはよく見られる。 |
ジフェニルブチルピリジン |
ピモジド |
1-10 |
就寝前に経口で3mg |
トゥレット症候群のみに承認 |
ピペラジン |
トリフルオペラジン フルフェナジン ペルフェナジン2 ' 3 |
2-40 0.5-40 12-64 |
就寝前に経口で10 mg、就寝前に経口で7.5 mg、就寝前に経口で16 mg |
デポ剤であるフルフェナジンデカノエートおよびフルフェナジンエナント酸エステルも存在する(用量当量はない)。 |
QTk - 心拍数に合わせて補正された 07 間隔。
1定型抗精神病薬の投与開始に関する現在の推奨は、最低用量から開始し、必要用量まで漸増することであり、就寝前に投与することが推奨されています。急速な用量漸増がより効果的であるというエビデンスはありません。急性期治療には筋肉内投与製剤が利用可能です。
従来の抗精神病薬には、鎮静、錯乱、ジストニアまたは筋硬直、振戦、プロラクチン値の上昇、体重増加(副作用の治療のため)など、深刻な副作用があります。アカシジア(運動不穏)は特に厄介で、服薬コンプライアンスの低下につながる可能性があります。これらの薬は、遅発性ジスキネジアを引き起こすこともあります。遅発性ジスキネジアは、唇や舌のしわ、腕や脚の「ねじれる」感覚などを特徴とする不随意運動障害です。従来の抗精神病薬を服用している患者における遅発性ジスキネジアの発症率は、年間薬剤使用量の約5%です。約2%の症例では、遅発性ジスキネジアによって外観が著しく損なわれます。一部の患者では、投薬を中止した後も遅発性ジスキネジアが無期限に持続することがあります。
2種類の伝統的な抗精神病薬と1種類の抗精神病薬が、長時間作用型デポ製剤として入手可能です。これらの製剤は、薬物の配合変化を回避するために使用されます。また、混乱、無関心、または病気への嫌悪感などにより、毎日経口で薬を服用できない患者さんにも役立ちます。
デポ型抗精神病薬
準備1 |
投与量 |
ピーク2までの時間 |
フルフェナジンデカノエート |
2~4週間ごとに12.5~50 mg |
1日 |
フルフェナジンエナント酸エステル |
1~2週間ごとに12.5~50 mg |
2日間 |
ハロペリドールデカノエート |
28日ごとに25~150 mg(場合によっては3~5週間ごと) |
7日間 |
リスペリドンマイクロスフェアS |
2週間ごとに25~50mg |
35日間 |
1 Zトラック法を用いて筋肉内に投与します。
2単回投与後の最高濃度に達するまでの時間。
初回注射から適切な血中濃度に達するまで3週間の遅延があるため、初回注射後3週間は経口抗精神病薬による治療を継続する必要があります。経口リスペリドンによる治療を開始する前に、忍容性を評価することが推奨されます。
クロザピンは、従来の抗精神病薬に抵抗性のある患者の約50%に効果があることが示されている唯一のSGAです。クロザピンは陰性症状を軽減し、運動副作用はほとんどなく、遅発性ジスキネジアを発症するリスクは最小限ですが、鎮静、低血圧、頻脈、体重増加、2型糖尿病、唾液分泌増加などの望ましくない副作用を引き起こします。クロザピンは発作を引き起こす可能性があり、この影響は用量依存的です。最も重篤な副作用は無顆粒球症で、患者の約1%に発生する可能性があります。そのため、白血球数の頻繁なモニタリングが必要であり、クロザピンは通常、他の薬剤に十分な反応を示さない患者の予備薬として使用されます。[ 92 ]、[ 93 ]
新しいSGAは、クロザピンの多くの利点を備えながら無顆粒球症のリスクがなく、急性発作の治療および増悪予防において、一般的に従来の抗精神病薬よりも好まれています。新しいSGAは有効性はほぼ同等ですが、副作用が異なるため、薬剤の選択は個人の感受性やその他の薬剤特性に基づいて行われます。例えば、長期維持療法を受けている患者において比較的高いリスクを有するオランザピンは、少なくとも6ヶ月ごとに評価を受ける必要があります。異常不随意運動スケール(ABM)などの評価ツールが使用される場合があります。神経遮断薬による悪性症候群(NMR)は、筋硬直、発熱、自律神経不安定性、およびクレアチニンホスホキナーゼ(CPK)の上昇を特徴とする、まれではあるものの致命的となる可能性のある有害事象です。
統合失調症患者の約30%は、従来の抗精神病薬に反応しません。このような場合、第二世代抗精神病薬であるクロザピンが効果的である可能性があります。
第二世代抗精神病薬による統合失調症の治療
第二世代抗精神病薬は、ドーパミン受容体とセロトニン受容体の両方を遮断することで作用します(セロトニン・ドーパミン受容体拮抗薬)。第二世代抗精神病薬は一般的に陽性症状を軽減しますが、陰性症状の軽減効果は従来の抗精神病薬よりも大きい可能性があります(ただし、この差については議論があります)。認知障害の発現リスクは低く、錐体外路系(運動機能)の副作用も少なく、遅発性ジスキネジアの発症リスクも低いです。一部の第二世代抗精神病薬はプロラクチン値を上昇させないか、わずかに上昇させる程度です。
病的不随意運動スケール
- 患者さんが診察室へ向かう途中の歩き方を観察します。
- チューインガムや入れ歯が問題を引き起こしている場合は、患者にそれらを取り除くように依頼してください。
- 患者が何らかの動きに気づいているかどうかを判断します。
- 患者には肘掛けのないしっかりとした椅子に座り、両手を膝の上に置き、足を少し開いて、足先を床に平らにつけてもらいます。診察中だけでなく、診察中も患者の全身を観察し、動きを評価します。
- 患者に、両腕を支えなしに膝の上に垂らした状態で座るよう指示します。
- 患者に口を2回開けてもらい、舌の動きを観察します。
- 患者に舌を2回突き出すように依頼します。
- 患者に、両手の親指で他の指を15秒間軽く叩いてもらいます。顔と脚を観察します。
- 患者に両腕を前に伸ばした状態で立ってもらいます。
各項目を、重症度の進行度に応じて0から4の尺度で評価してください。0 - なし、1 - 軽度(正常範囲の極限に近い)、2 - 軽度、3 - 中等度、4 - 重度。活動後にのみ運動が認められる場合は、自発的に現れる運動よりも1ポイント低く評価してください。
顔と口の動き |
表情 唇と口囲 ジョーズ 言語 |
四肢の動き |
手 脚 |
胴体の動き |
首、肩、腰 |
一般的な結論 |
病的運動の重症度 病的運動による障害 患者の異常な動きに対する認識(0 - 認識なし、4 - 重度の苦痛) |
出典:ECDEU精神薬理学評価マニュアル(W. Guy著)。著作権1976年米国保健教育福祉省。
体重増加、高脂血症、および2型糖尿病のリスク増加は、ACE阻害薬の主な副作用です。したがって、ACE阻害薬による治療を開始する前に、すべての患者について、糖尿病の既往歴/家族歴、体重、ウエスト周囲径、血圧、空腹時血糖値、脂質プロファイルなどのリスク因子についてスクリーニングを行う必要があります。患者と家族は、糖尿病の徴候と症状(多尿、多飲、体重減少)に加え、糖尿病性ケトアシドーシス(吐き気、嘔吐、脱水、呼吸数の増加、霧視)についても説明を受ける必要があります。さらに、ACE阻害薬の投与を開始するすべての患者は、栄養と身体活動についてカウンセリングを受ける必要があります。抗精神病薬による治療を受けるすべての患者は、体重、BMI(体格指数)、空腹時血糖値を定期的にモニタリングする必要があり、高脂血症または2型糖尿病を発症した場合は、特別な評価を受ける必要があります。神経遮断薬による悪性症候群は、新規に発売された神経遮断薬を含む、ほぼすべての抗精神病薬と関連していることが報告されています。[ 94 ]
第二世代抗精神病薬1
ラス |
準備 |
線量限度 |
成人の平均線量 |
コメント |
ジベンゾジアゼピン |
クロザピン |
1日2回、150~450mgを経口投与 |
就寝前に400mgを経口投与 |
治療抵抗性患者に有効性を示した初のASA。無顆粒球症のリスクがあるため、白血球数の頻繁なモニタリングが必要。また、発作や体重増加のリスクが高まる。 |
ベンゾオキサゾール |
リスペリドン |
就寝前に4~10mgを経口投与 |
就寝前に経口で4mg |
6 mgを超える用量では錐体外路症状を引き起こす可能性がある。用量依存的にプロラクチン値が上昇する。長時間作用型の注射剤がある唯一のASAIDである。 |
チエノベンゾジアゼピン |
オランザピン |
10~20mgを経口投与 |
就寝前に15mgを経口投与 |
眠気、体重増加、めまいが最も一般的な副作用です。 |
ジベンゾチアゼピン |
クエチアピン |
1日2回、150~375mgを経口投与 |
200 mgを1日2回経口投与 |
低力価のため幅広い用量設定が可能であり、抗コリン作用はない。α受容体遮断作用のため用量の漸増が必要であり、1日2回投与が必要である。 |
ベンゾイソチアゾリルピペラジン |
ジプラシドン |
40~80 mgを1日2回経口投与 |
80 mgを1日2回経口投与 |
セロトニンおよびノルアドレナリンの再取り込みを阻害し、抗うつ作用を有する可能性がある。新薬の中で最も半減期が短く、1日2回食事と一緒に投与する必要がある。急性症状には筋肉内投与が可能である。体重増加の傾向は低い。 |
ジヒドロカロスティリル |
アリピプラゾール |
10~30mgを経口投与 |
就寝前に15mgを経口投与 |
部分ドパミン2受容体作動薬、体重増加傾向が低い |
APVP は第二世代の抗精神病薬です。
1このクラスの抗精神病薬では、体重増加と 2 型糖尿病の発症のモニタリングが推奨されます。
第二世代抗精神病薬はすべて、高齢の認知症患者の死亡率の上昇と関連しています。
非定型神経遮断薬による統合失調症の治療は、統合失調症患者に対する定型神経遮断薬の処方開始とほぼ同時に始まりました。
リハビリテーションと社会支援サービス
心理社会的スキル訓練と職業リハビリテーションプログラムは、多くの患者が仕事、買い物、身の回りの世話、家事、他者との良好な関係、そしてメンタルヘルス専門家との連携を行えるよう支援します。患者が競争の激しい職場環境に置かれ、職場への適応を促進するために職場のメンターが提供される場合、就労維持は特に効果的です。しかし、職場のメンターは、時間の経過とともに、意思決定や雇用主とのコミュニケーションにおけるバックアップとしての役割のみを果たします。
地域密着型支援サービスにより、多くの統合失調症患者が地域社会で生活することが可能になっています。ほとんどの患者は自立して生活できますが、服薬コンプライアンスを確保するためにスタッフが常駐する、管理付き住宅を必要とする患者もいます。プログラムでは、24時間体制のサポートから定期的な自宅訪問まで、様々な環境で段階的な監督を提供します。これらのプログラムは患者の自立を支援すると同時に、適切な医療を提供することで再発や入院の必要性を軽減します。地域密着型治療プログラムは患者の自宅やその他の場所で行われ、患者に対するスタッフの比率が高く、治療チームが必要な治療のほとんどまたはすべてを直接提供します。
重度の増悪時には、入院または病院での危機介入が必要となる場合があり、患者が自身または他者に危険を及ぼす場合は、強制入院が必要となることもあります。リハビリテーションや社会福祉サービスが改善されているにもかかわらず、特に重度の認知障害を持つ患者や治療に抵抗性のある患者など、少数の患者は長期の入院やその他の支持療法を必要とします。
心理療法
統合失調症に対する現在の心理療法モデルは、過去の努力が失望に終わったことによりかなり抑制され、その目的はより控えめで実際的であり、薬理学的介入を中核とする包括的治療の一部とみなされている。[ 95 ] 心理療法の目標は、患者、家族、医師の間に統合された関係を構築し、患者が自分の病気を理解して管理し、処方された薬を処方どおりに服用し、ストレスにもっと効果的に対処することを学ぶことである。一般的なアプローチは個人心理療法と薬物療法を組み合わせることであるが、そのための実際的なガイドラインはほとんどない。最も効果的な心理療法は、患者の基本的な社会的ニーズに対処することから始め、病気の性質についてのサポートと教育を提供し、適応機能を促進し、共感と統合失調症に対する適切な動的理解に基づいたものである。多くの患者は、この病気がしばしば生涯にわたる障害であり、著しく機能を制限する可能性があるという事実に適応するために、共感的な心理的サポートを必要とする。
家族と暮らす患者の場合、心理教育的な家族介入によって再発率が低下する可能性があります。全米精神障害者同盟(National Alliance on the Mentally Ill)などの支援団体や擁護団体は、家族にとって役立つことが多いです。
治療の詳細
予測
発症後5年間は、生活機能が低下し、社会的・職業的スキルが低下し、セルフケアへの怠慢が徐々に増加する可能性があります。陰性症状の重症度が増し、認知機能が低下することもあります。その後、障害は一定レベルに達します。特に女性においては、加齢とともに重症度が低下する可能性があるというエビデンスがあります。重度の陰性症状と認知機能障害を有する患者は、抗精神病薬を使用しなくても、多動性障害を発症する可能性があります。
統合失調症の病型によって予後は異なります。妄想型統合失調症の患者は障害が軽く、治療への反応も良好です。一方、欠陥型統合失調症の患者は通常、障害が重く、予後が悪く、治療への抵抗性も高くなります。
統合失調症は他の精神障害と関連することがあります。[ 96 ] 強迫性障害の症状を伴う場合、予後は特に不良です。一方、境界性パーソナリティ障害の症状を伴う場合は、予後は良好です。統合失調症患者の約80%は、人生のある時点で、うつ病のエピソードを1回以上経験します。
診断後 1 年間の予後は、処方された向精神薬の厳格な遵守と密接に関係しています。全体として、患者の 1/3 は顕著かつ永続的な改善が見られます。1/3 はある程度の改善が見られますが、定期的な増悪と後遺症が残り、1/3 は重度で持続性の症状が残ります。全患者のうち、発病前の機能レベルに完全に回復するのはわずか 15% です。良好な予後に関連する要因としては、発病前の機能が良好であること (例: 優れた学業成績、仕事の成功)、発病が遅いおよび/または突然であること、統合失調症以外の気分障害の家族歴があること、認知障害が最小限であること、陰性症状が軽度であること、妄想型または非欠陥型であることが挙げられます。不良な予後に関連する要因としては、発症年齢が若いこと、発病前の機能が低いこと、統合失調症の家族歴があること、および多重陰性症状を伴う解体型または欠陥型のサブタイプが挙げられます。男性は女性よりも予後が悪く、女性は抗精神病薬療法に対する反応が良好です。
アルコールや薬物の乱用は、統合失調症患者の約50%に深刻な問題として見られます。事例証拠によると、マリファナやその他の幻覚剤は統合失調症患者にとって極めて破壊的な影響を及ぼす可能性があり、使用を控えるべきです。薬物乱用の併発は予後不良の強い予測因子であり、服薬不遵守、再発、頻繁な入院、機能低下、そしてホームレスを含む社会的支援の喪失につながる可能性があります。


