狂犬病、または狂犬病は、感染した動物に噛まれることで感染する急性ウイルス性疾患で、神経系に損傷を与え、重度の脳炎を発症して致命的な結果をもたらします。
疫学
狂犬病ウイルスは古代から公衆衛生上の脅威であり、現在では毎年約59,000人の命を奪っています。そのほぼ全てが犬の咬傷によって感染しています。これは、特にアフリカやアジアといった発展途上国にとって大きな経済的打撃となります。これらの国々は、こうした損失を最も受けにくいからです。しかし、致死率がほぼ100%であるにもかかわらず、犬の狂犬病は完全に予防可能な病気であり、先進国における犬の狂犬病根絶の歴史的事例がそれを証明しています。[ 1 ]
原因 狂犬病
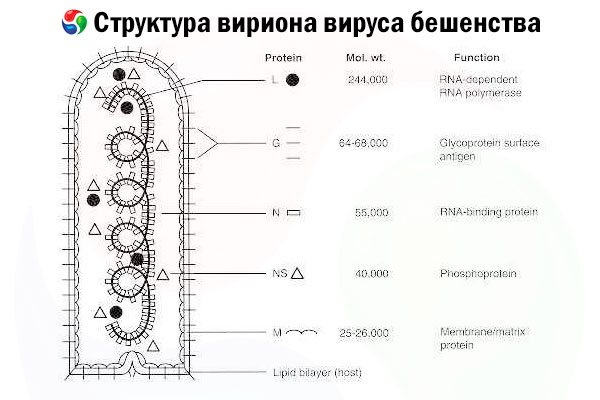
原因物質は狂犬病ウイルス (RV) であり、ラブドウイルス科のマイナス鎖 RNA ウイルスで、大きさは約 60 nm × 180 nm です。
核酸を含む内側のタンパク質核(ヌクレオカプシド)と、脂質を含む二重層で、膜貫通糖タンパク質スパイクで覆われた外膜から構成されています。比較的単純なモジュール型ゲノム構造を持ち、以下の5つの構造タンパク質をコードしています。
- RNA依存性RNAポリメラーゼ(L)、
- 核タンパク質(N)
- リン酸化タンパク質(P)
- マトリックスタンパク質(M)と
- 外表面糖タンパク質(G)。
N、P、Lタンパク質はゲノムRNAと共にリボ核タンパク質複合体を形成する。Gは、致死的なRV感染に対する主要な免疫エフェクターであるRV中和抗体の産生を誘導できる唯一のRV抗原である。一方、リボ核タンパク質複合体は、CD4陽性T細胞を誘導できる主要なRV抗原であることが示されており、CD4陽性T細胞は構造内抗原認識を通じてRV中和抗体の産生を促進する。[ 2 ] リボ核タンパク質複合体は、免疫記憶および長期免疫の確立において重要な役割を果たす可能性がある。[ 3 ]
分類と抗原の種類
リッサウイルス属には、狂犬病ウイルスと、抗原的および遺伝的に関連する狂犬病ウイルス(ラゴス、モコラ、デューベンハーゲコウモリウイルス)に加え、ヨーロッパコウモリリッサウイルスの推定亜型2種が含まれます。交差防御試験では、従来の狂犬病ワクチンで免疫を獲得した動物は、他のリッサウイルスによる攻撃に対して十分な防御効果が得られない可能性があることが示されています。
狂犬病ウイルスは、固定型(動物または細胞培養による継代によって適応したもの)とストリート型(野生型)に分類されます。モノクローナル抗体と遺伝子配列解析を用いてストリート型狂犬病ウイルスを区別することで、世界中の主要な宿主リザーバーに由来するウイルス変異体の特定や、患者に明確な動物咬傷歴がない場合のヒトへの曝露源の推定に役立っています。[ 8 ]
病因
野生動物における主な感染源および病原体は、オオカミ、キツネ、ジャッカル、コウモリです。また、家畜(犬や猫)においても、まれに馬、牛、豚、ネズミなどが感染源となります。人から人への感染は、可能性はあるものの、極めて稀です。これは典型的な人獣共通感染症です。狂犬病は主に犬から人に感染します。
人間が病的な動物に咬まれると、ウイルスは咬傷部位の筋肉組織で増殖し、感覚末梢神経末端に到達した後、求心性に広がり、運動ニューロンに到達します。ウイルスが移動して脳に影響を及ぼすまでの時間は、咬傷部位によって異なります。頭部や顔面の重度の咬傷の場合、ウイルスは15~20日で中枢神経系に到達しますが、体幹や四肢の皮膚損傷が軽微で、病原体の量が少ない場合は、ウイルスが中枢神経系に移行するプロセスが数ヶ月、あるいは1~1年半も遅れることがあります。中枢神経系に到達したウイルスは、脳と脊髄の組織、主に延髄、アンモン角、脳底のニューロンに定着します。脊髄では、後角が最も影響を受けます。ウイルスは中枢神経系から神経幹に沿って遠心的に唾液腺に到達し、そこで増殖して唾液とともに排出されます。
狂犬病の病因に関する概念
RVは宿主域が広く、ほぼ全ての哺乳類に感染する可能性があります。RVの感染経路は複数報告されていますが、自然感染では咬傷が最も一般的です。咬傷に加えて、RVに感染した死骸の摂取もホッキョクギツネにおける狂犬病ウイルス感染を促進する可能性があり、RVの粘膜への接触も感染経路となる可能性があります。[ 9 ] 実験室でRVがエアロゾルとして偶発的に放出された場合や、多数のコウモリが生息する洞窟でRVがエアロゾルとして放出された場合など、まれな状況では[ 10 ]、エアロゾル感染が発生することがあります。
ストリートRVおよびマウス適応RV株、あるいは組織培養適応RV株が、中枢神経系に入る前に接種部位で複製するかどうかはまだ明らかではない。幼少ハムスターまたはアライグマにストリートRVを実験的に筋肉内感染させたところ、ウイルスが神経筋接合部を越えて運動ニューロンの軸索に侵入する前に、横紋筋細胞でRVが複製されることが明らかになったが[ 11 ]、[ 12 ]、マウスにマウス適応CVS-24 RVを筋肉内感染させたところ、RVは接種部位で事前に複製されることなく中枢神経系に直接移行することが示された[ 13 ]。無髄軸索末端に到達したRVは、逆行的に細胞体へと輸送される。
最近の知見によると、軸索小胞輸送は、軸索内でのウイルス粒子の長距離移動における重要な戦略である可能性が示唆されている。[ 14 ] RVは軸索内を毎時3 mmの速度で移動すると推定されている。[ 15 ] その後、感染はシナプス結合部でつながれたニューロン連鎖を通じて広がる。しかし、シナプス伝達を促進する正確なメカニズムはまだ不明である。脳に感染した後、ウイルスは多くの末梢臓器の末梢神経系および自律神経系へと遠心的に広がる。[ 16 ] 感染サイクルの最終段階では、RVは唾液腺に移動し、粘液産生腺房細胞で複製された後、唾液中に放出され、次の宿主への感染準備が整う。[ 17 ]
狂犬病ウイルス誘発性病理に関しては、固定株のRVに感染したマウスの実験的狂犬病モデルにおいて、アポトーシス細胞死が潜在的な発症メカニズムとして提案されている。[ 18 ] 狂犬病の重篤な中枢神経系機能障害の特徴に寄与する可能性のある発症メカニズムは、神経機能障害の可能性がある。RVに感染したニューロンでは遺伝子発現が著しく低下し、タンパク質合成が全体的に抑制されることが示されており[ 19 ]、いくつかの研究ではRV感染後に神経伝達が障害されることが示されている。Jiangは、感染したラットの脳ホモジェネートへのアセチルコリン受容体拮抗薬の結合が、対照群と比較して減少していることを実証した。[ 20 ] 睡眠周期、痛覚、行動の制御に関与する神経伝達物質であるセロトニンの放出と結合の障害も、RVに感染したラットの脳で観察された。 [ 21 ], [ 22 ] 右室感染は神経伝達に影響を与えるだけでなく、イオンチャネルにも影響を及ぼす可能性があります。感染したマウス神経芽腫細胞では、電位依存性ナトリウムチャネルの機能発現が低下し、活動電位の発生が阻害され、最終的には機能障害につながる可能性があります。[ 23 ]
ヒトの狂犬病では、中枢神経系に重篤な病変が認められないことに加え、臨床症状の発現から7~10日後には免疫反応がほとんど発現しない。狂犬病の病因と他の多くのウイルス性または細菌性中枢神経系感染症の病因との間にはこのような大きな違いがあり、免疫抑制が狂犬病の転帰に効果がない、あるいは有害であるという事実によってさらに裏付けられている[ 24 ]。狂犬病患者にしばしば観察される免疫反応の低レベルは、RV抗原の免疫原性の低さだけでは説明できないため不可解である。実際、RV Gおよびヌクレオカプシドタンパク質は、非経口投与された場合、B細胞およびT細胞に対する強力な抗原となる。 [ 25 ] 狂犬病に罹患したヒトや動物におけるRVに対する免疫応答が低い理由としては、中枢神経系のRV感染が免疫抑制を引き起こすことが考えられる。[ 26 ] また、RVはアポトーシスを阻害し、侵入したT細胞を破壊するなどの破壊的な戦略をとるのではないかとも考えられている。[ 27 ]
非神経細胞に適応した弱毒化RV株は、病原性のストリートRV株とは神経侵襲性、すなわち末梢から中枢神経系に侵入する能力において大きく異なります。この点において、組織培養適応RV株は末梢から中枢神経系に侵入する能力がないか、あるいは非常に限られているのに対し、ストリートRV株やCVS-24などのマウス適応RV株は高い侵襲性を示します[ 28 ]。RVの神経侵襲に関与する主要な因子としては、ウイルスの取り込み、軸索輸送、シナプス透過性伝播、およびウイルス複製速度などが挙げられます。
最近まで、狂犬病の病因に関する知識は限られており、主に路上感染株の記述的研究や、実験室で適応させた弱毒株を用いた実験感染に基づいていました。リバースジェネティクス技術の登場により、狂犬病の病原性表現型を決定するウイルス要素を特定し、狂犬病の病因に関与するメカニズムをより深く理解することが可能になりました。
狂犬病ウイルスの獲得、伝播、複製を制御するウイルス要素の同定
- ウイルス捕捉に関与するウイルス要素
RV 感染は、ウイルスが推定上の細胞受容体に付着することで始まる。RV 受容体としては、ニコチン性アセチルコリン受容体[ 29 ]、神経細胞接着分子[ 30 ]、低親和性神経栄養因子受容体 p75 NTR[ 31 ] などいくつかの膜表面分子が提案されているが、これらの分子が実際に狂犬病ウイルスのライフサイクルで役割を果たしているかどうかはまだ不明である。これに関連して、RV G–p75 NTR 相互作用は一次ニューロンの RV 感染には必要ないことが最近示された[ 32 ]。受容体結合後、RV は吸着または受容体介在性エンドサイトーシスにより内部化される[ 33 ]。次に、エンドソーム区画内の低 pH 環境が RV G の構造変化を誘導し、それがウイルス膜とエンドソーム膜の融合を引き起こし、RNP を細胞質に放出する。 [ 34 ] ウイルスの場合、RV Gはウイルスの取り込みにおいて重要な役割を果たしており、これはおそらく、迅速な取り込みを促進する推定細胞受容体との相互作用を介していると考えられます。この点で、組織培養に適応したRV株(ERA、HEP、CVS-11など)の病原性は、Gタンパク質の抗原部位IIIに位置する決定因子の存在と相関していることが実証されています。[ 35 ] ERA Gタンパク質のこの抗原部位の333番目のArg → Gln変異は、野生型変異体と比較して、Gln333 RV変異体の内在化を7倍遅らせました。病原性表現型の再出現を説明するRV GのAsn194→Lys194変異は、内部化時間の大幅な短縮と関連していた。[ 36 ] さらに、キメラRVの実験では、銀由来コウモリ関連株RV-18のcDNAクローンから派生した高病原性SB RV株のG遺伝子を、SAD B19 RVワクチン株のcDNAクローンから分離された高度に弱毒化されたSN株のG遺伝子に置換した後、RVビリオンの内部化に必要な時間が大幅に増加し、病原性が大幅に低下したことが示された。[ 37] [38]これらのデータを合わせると、RV Gの機能であるウイルス取り込みの速度が、RV病原性の主な決定要因であるという考えが裏付けられる。
- ウイルスの拡散と伝播に関与するウイルス要素
狂犬病ウイルスのユニークな特性は、細胞から細胞へと伝播する能力です。Gln333 ERA変異体がin vitroにおいてpH依存性の細胞間融合活性を失い[ 39 ]、細胞から細胞への伝播能力が大幅に低下しているという観察結果[ 40 ]は、RV Gも細胞間伝播、ひいてはウイルス伝播において重要な役割を果たしていることを示唆しており、これはおそらくその融合活性によるものと考えられます。この可能性は、病原性RV復帰変異体SPBNGAKの伝播速度が、非病原性SPBNGA変異体のほぼ2倍であるという知見によってさらに裏付けられています。興味深いことに、G SPBNGAKのAsn 194 → Lys 194変異は、膜融合のpH閾値をより高いpHにシフトさせ、膜融合のpH閾値の上昇がウイルス伝播の増加と関連しているという仮説を裏付けています。[ 41 ]
ラット [ 42 ] およびアカゲザル [ 43 ]におけるRV感染の経ニューロン指標の研究では、狂犬病ウイルスは軸索中を逆方向にのみ移動することが示されている。いくつかのRVタンパク質がニューロン輸送機構に関与しているが、RV感染の経ニューロン拡散ではRV Gが主要な役割を果たしていると思われる。例えば、RV Gで擬似体化された馬伝染性貧血ウイルス(EIAV)の末梢感染では脊髄へのウイルス移行が生じるが、水疱性口内炎ウイルスGで擬体化された同じEIAVは神経系に侵入できなかった。 [ 44 ] さらに、ERA G Arg 333 → Gln 333変異体のCNSでのウイルス拡散は野生型変異体に比べて大幅に減少していることが判明し、さらに、RV Gがシナプス透過拡散に機能することを示唆している。しかし、トランスシナプス輸送におけるRV Gの重要な役割について最も説得力のある証拠は、組換えG欠損RVウイルスをマウスに頭蓋内に感染させた実験から得られており、感染は接種部位のニューロンに限定され、二次ニューロンへの拡散の証拠は見られなかったことが示された[ 45 ]。しかし、RV Gに加えて、RV Mもウイルスの拡散、ひいてはトランスシナプス輸送に役割を果たしている可能性が高い。この点で、病原性の高いSB由来のMとGの両方を含むキメラSN-BMBG RV変異体の拡散は、それぞれSB由来のGとMを含むキメラSN-BGまたはSN-BM変異体の拡散よりも有意に高いことが示されており、細胞間のウイルス拡散にはMとGの最適な相互作用が重要な役割を果たしている可能性があることを示唆している。 [ 46 ] RV Mはウイルスの出芽をサポートするため、[ 47 ] RV SN-BMBGキメラ変異体のより効率的な拡散は、シナプス後膜での最適なウイルス出芽によるものである可能性が高い。
最近の研究では、RV Pとダイニン軽鎖との相互作用によってRV RNPが宿主細胞の輸送システムに結びつき、ウイルスの逆行性軸索輸送が促進されることが示されている。[ 48 ],[ 49 ]しかし、成体マウスの末梢感染では、RV PのLC8結合ドメインを欠失してもウイルスのCNSへの侵入は妨げられず、RVタンパク質がRVの逆行性軸索拡散に直接関与していないことが示唆されている。[ 50 ]
- ウイルスの複製を制御するウイルス要素
インフルエンザウイルスなど他の多くのウイルスとは異なり、RVの病原性はウイルスRNAの合成速度および感染性ウイルス粒子の産生に反比例する。様々なキメラウイルスによって産生されるウイルスmRNAとゲノムRNAのレベルを比較すると、ウイルスRNAの転写と複製は、初期の高レベルのmRNA合成からゲノムRNA合成への切り替えを媒介するトランスアクティング因子として同定されているRV Mを含む複数の因子によって制御されていることが示唆される。[ 51 ] さらに、すべてのラブドウイルスのMはRNPに結合してウイルス遺伝子の発現を遮断し、RNA合成をサポートできない高度に凝縮されたバックボーンのような構造を形成する。
ウイルス複製を制御することで病原性を制御する他のウイルス要素を同定するため、高病原性SB株の5'末端配列を、高度に弱毒化されたSNワクチン株の配列に段階的に置換し、SB2(末端配列[TS] + L)、SB3(TS + L + 擬似遺伝子[Ψ])、SB4(TS + L + Ψ + G)、およびSB5(TS + L + Ψ + G + M)という組み換えウイルスを作製した。親ウイルスであるSBおよびSNウイルス、ならびにキメラRVであるSB2、SB3、SB4、およびSB5の筋肉内感染は、SB感染マウスで最も高い死亡率を引き起こしたが、SN感染マウスでは罹患率も死亡率も認められなかった。 TS、L、および SB を SN の対応する要素に置き換えると、罹患率と死亡率がわずかに減少し、追加の G または G と M の交換により、ウイルスの病原性が大幅に減少するか、完全に消失しました。
組織培養におけるこれらの野生型およびキメラRVの表現型解析により、特定のRVの病原性は神経細胞内での複製能力と逆相関していることが明らかになりました。SBの複製レベルはSNの約1000分の1であり、SBのTS、L、およびSNレベルへの置換はウイルス増殖速度にほとんど影響を与えませんでしたが、SBのGまたはG+Mを対応するSN遺伝子に置換すると、ウイルス産生が1倍増加しました。これは、ウイルスRNA複製速度とウイルス粒子産生がRV Gタンパク質によって大きく制御されていることを示唆しています。この結論は、Gタンパク質のアミノ酸が1つ異なるRV G変異体で得られたデータによって裏付けられています。病原性狂犬病ウイルス変異株 SPBNGAK 194 が NA 細胞で産生したウイルス力価は、非病原性変異株 SPBNGAN 194 によって産生されるものより 1 log 低く、リアルタイム PCR 分析により、SPBNGAK に感染した NA 細胞におけるウイルス RNA の転写および複製速度は、SPBNGAK に感染した NA 細胞よりも 5 倍と 10 倍高いことが示されました。[ 52 ] 病原性とウイルス RNA 合成速度およびウイルス粒子産生速度との間の逆相関のさらなる証拠は、弱毒化 SN 株の G および M 遺伝子を高病原性 SB 株の遺伝子に置き換えたキメラ組み換えウイルスに感染したマウスによって提供されました。これらの実験により、RV G を保有する親 SN 株の病原性が、病原性 SB 株より大幅に増加していることが明らかになりました。SB の G および M の両方を SN に導入すると、病原性はさらに増加しました。
SN の G または M またはその両方を SB の対応する遺伝子に置換すると、ウイルス粒子生成速度およびウイルス RNA 合成速度が大幅に低下しました。これらのデータは、G と M の両方がウイルス複製を調節することにより RV の病因において重要な役割を果たしていることを示しています。SN の G または G と M を SB の G または G と M に置換すると、ウイルス RNA の転写および複製がそれぞれ中程度から大幅に減少するのに対し、SN の M のみを SB の M に置換すると、ウイルス RNA の転写および複製が大幅に増加するという知見は、RV G も単独で、または M タンパク質との相互作用を介して、ウイルス RNA の転写/複製において重要な調節機能を持っていることを示しています。RV G 遺伝子がウイルス RNA 合成を制御するメカニズムは不明です。細胞性miRNAによる標的認識が、ウイルス複製の正または負の調節をもたらすことが示されている。[ 53 ] RV G遺伝子配列内のArg 333 → Glu 333またはLys 194 → Ser 194の置換は、miRNA標的配列の廃止をもたらし、それが今度はウイルスRNA合成速度の大幅な増加と関連している[Faber M、トーマス・ジェファーソン大学、ペンシルベニア州、米国、未発表データ]。これは、水疱性口内炎ウイルスやHCVなどの他のRNAウイルスの場合と同様に、宿主細胞のmiRNAもRV複製の調節に重要な役割を果たしていることを示唆している。[ 54 ]、[ 55 ]
ウイルス複製の制御は、RVの病因に関わる重要なメカニズムの一つであると考えられます。病原性RV株は免疫応答を回避し、神経ネットワークの完全性を維持するために、弱毒化株とは異なり、増殖速度を制御できます。病原性RV株にとって、複製速度が低いことは、これらのウイルスが中枢神経系に到達するために使用する神経構造を維持するという利点があると考えられます。病原性RVの複製速度が低いもう一つの理由は、宿主の免疫系による早期検出を回避するために、ウイルスが抗原の発現を最小限に維持しているというものです。
RV G発現、アポトーシスおよび病原性の関係
組織培養に順応した株よりも病原性が著しく高いストリート狂犬病ウイルス株は、非常に限られたレベルのGを発現し、感染サイクルの後期までアポトーシスを誘導しないことがよく知られており、特定のウイルス株の病原性がRV G発現およびアポトーシス誘導能力と逆相関していることを示唆しています。[ 56 ] G発現レベルとアポトーシスの程度の相関関係の直接的な証拠は、2つの同一のG遺伝子を持ち、RV Gを過剰発現した組み換えRV SPBNGA-GAで得られました。[ 57 ] この組み換えRVに感染した神経細胞培養の形態学的研究は、RV G過剰発現と並行して細胞死が著しく増加し、アポトーシスがRV Gを介した細胞死に関与する主要なメカニズムであることを示しました。特に、SPBNGA-GA感染後のF-アクチン染色の減少は、アポトーシス誘導性のアクチンフィラメントの脱重合と一致しています。さらに、SPBNGA-GAに感染したニューロンのTUNEL陽性核の数は、非感染ニューロンおよびSPBNGAに感染したニューロンと比較して有意に増加していた。しかし、RV G遺伝子がアポトーシスシグナル伝達プロセスを媒介するメカニズムは、ほとんど不明のままである。RV G発現が一定の閾値を超えると、細胞膜が著しく破壊されることが示唆されている。アポトーシス細胞はCNSで速やかに除去されず、二次壊死を起こす可能性が高い。[ 58 ]一方、RV感染、特にRV Gタンパク質の過剰発現は、アポトーシスに似た細胞死の経路であるピロプトーシスを引き起こす可能性があるが、アポトーシスとは異なり、カスパーゼ1が活性化され、それによって壊死につながる。[ 59 ]RV感染によって誘発される壊死またはピロプトーシスの程度は、抗ウイルス免疫の誘導に重要な役割を果たしている可能性が高い。アポトーシス細胞は膜の完全性を維持し、自然免疫応答を刺激しませんが、壊死細胞は透過性になり、強力な自然免疫応答を引き起こすことができる内因性アジュバントを分泌します。[ 60 ]
アポトーシス/ネクローシスのレベルはRVの免疫原性と相関関係にあることから、アポトーシス/ネクローシス細胞の免疫刺激作用が防御免疫応答の生成に寄与している可能性が高いことが示唆されている。したがって、RV Gの発現制御は、明らかな神経損傷を引き起こすことなく、感染を予防する防御免疫応答を誘導することなく、病原性RV変異体が神経系内で生存し拡散する手段を提供するため、狂犬病の病因において重要な因子である可能性が非常に高い。
RV Gの発現は、RNA合成レベル、翻訳後レベル、またはその両方で制御されている可能性がある。異なるRVキメラ変異体によって発現されるRV Gのレベルは、ウイルスRNA合成速度に反映されることが示されており、これらの変異体によるRV G発現の異なる制御は、ウイルスmRNA転写速度の変動に起因することを示唆している。ウイルスRNA転写速度と同様に、これらの変異体によって発現されるRV Gの量は、ウイルスの病原性と逆相関している。一方、病原性の低いRV変異体CVS-B2cを一次神経細胞培養に感染させたところ、病原性の高い変異体CVS-N2cを感染させた場合と比較して、G mRNAの合成レベルは同程度であったにもかかわらず、Gタンパク質のレベルは4倍に上昇した。パルスチェイス実験により、CVS-B2c感染ニューロンにおけるGタンパク質レベルの上昇は、主にCVS-B2c Gタンパク質の分解速度がCVS-N2c Gタンパク質よりも遅いことに起因することが示されました。しかし、CVS-N2c Gタンパク質のより急速なタンパク質分解につながるメカニズムは未だ解明されていません。
症状 狂犬病
狂犬病の潜伏期間は平均30~90日です。頭部や顔面の大きな傷口からの重篤な感染の場合は、12日に短縮されることもあります。まれに、潜伏期間が1年以上続くこともあります。
病気には、前駆期、興奮期、麻痺期という 3 つの期間が厳密に順番に変化します。
前駆期は、咬まれた部位に痛みや引っ張られるような痛み、神経に沿った痛みが現れることから始まります。傷跡の領域には、灼熱感、かゆみ、時には発赤や腫れが生じることがあります。患者は全身倦怠感、頭痛、吐き気を経験します。嘔吐、体温の37.5〜38°Cへの上昇、進行性の精神障害の症状(反射興奮性の増加、説明のつかない不安感、恐怖、憂鬱感)が認められます。多くの場合、患者は落ち込み、抑制され、引きこもり、食事を拒否し、睡眠不足になり、暗い考えや恐ろしい夢を訴えます。前駆期は2〜3日続きますが、7日間に及ぶこともあります。この期間の終わりには、一時的な呼吸困難、胸の圧迫感、頻脈、呼吸数の増加を伴う不安発作が起こることがあります。
興奮期には恐水症が現れる:水を飲もうとしている時、そして水を見たり、水を思い出させたりすると、患者は咽頭と喉頭のけいれん性痙攣を経験し、その間、患者は悲鳴を上げてコップに入った水を放り投げ、震える手を前に投げ出し、頭と体を後ろに倒します。首は伸び、苦痛に満ちたしかめっ面が顔をゆがめ、呼吸筋の痙攣により顔は青みがかります。目は飛び出し、恐怖を表し、助けを求め、瞳孔は散大し、吸入は困難です。発作のピーク時には、心停止と呼吸停止の可能性があります。発作は数秒間続き、その後、患者の状態は改善しているように見えます。その後、空気の動き(空気恐怖症)、明るい光(光恐怖症)、または大きな声(聴覚恐怖症)によっても、咽頭と喉頭の筋肉の痙攣発作が起こることがあります。発作は精神運動性の興奮を伴い、患者は「狂人」のように振る舞います。発作中は意識が混濁しますが、発作間欠期には回復します。興奮期には交感神経系の緊張亢進により、唾液分泌が急増し(流涎症)、咽頭筋の痙攣により唾液を飲み込むことができなくなります。患者は唾液を噴き出します。一部の患者では髄膜炎や後弓反張症の兆候が現れることもあり、痙攣もよく見られます。この場合、脳脊髄液に変化がない場合もありますが、一部の患者ではタンパク質濃度の上昇やリンパ球による細胞数の増加がみられることがあります。
適切な治療を受けない場合、脱水症状が悪化し、顔貌が鋭くなり、体重が減少します。体温は高値に上昇し、痙攣を起こす可能性があります。興奮期の持続期間は約2~3日ですが、まれに4~5日続くこともあります。通常は、いずれかの発作中に致命的な転帰を辿ります。まれに、患者が第3期まで生存することもあります。
麻痺期間中、患者は落ち着きます。恐水症の発作は治まり、患者は飲食が可能になり、意識は明瞭です。しかし、一見健康そうに見えても、やがて無気力、無関心、抑うつ症状の悪化、四肢麻痺、骨盤障害、脳神経麻痺が現れます。体温は42~43℃まで上昇し、血圧は低下し、1日目には心血管系と呼吸器系の麻痺により死に至ります。
末梢血中に好中球増多、ヘモグロビン、赤血球、ヘマトクリットの増加が観察されます。
あなたを悩ましているのは何ですか?
フォーム
臨床的には、定型と非定型に区別されます。非定型には、覚醒および恐水症状を伴わないすべての症例が含まれます。非定型には、球麻痺型、小脳麻痺型、髄膜脳炎型などがあります。
診断 狂犬病
狂犬病抗原、抗体、ウイルスRNAの検出、またはウイルス分離によって狂犬病の診断が可能です。狂犬病患者では、いずれの検査も陰性となる場合があるため、特に狂犬病が強く疑われる場合は、狂犬病抗体検出のための連続血清検体、ウイルス培養のための唾液検体、およびウイルス抗原の直接蛍光抗体法による検査のための皮膚生検が必要となることがあります。
ヒトにおける生前狂犬病の最も迅速な診断方法の一つは、頸部皮膚生検で狂犬病抗原を検出する直接蛍光抗体法です。直接蛍光抗体法は、皮膚やその他の新鮮組織(例:脳生検)中の狂犬病抗原を検出する最も感度と特異度の高い方法ですが、発症初期には陰性となる場合もあります。新鮮組織が入手できない場合は、固定組織を酵素消化することで蛍光抗体法の反応性を高めることができますが、感度が許容できないほど低くなる可能性があります。
神経芽腫細胞または実験用げっ歯類に接種した後、唾液からウイルスを分離して診断を確定することもできます。これは通常、発症後 2~3 週間に最も効果的です。ワクチン接種を受けていない人の血清で、通常迅速蛍光フォーカス阻害試験 (RFFIT) によって行われる狂犬病ウイルス中和抗体の検出も診断に有効です。脳脊髄液中に抗体が存在すると診断が確定しますが、抗体は血清抗体よりも 2~3 日遅れて出現することがあるため、病気の初期段階ではあまり役に立ちません。ワクチン接種後の血清学的反応は、通常、病気によって引き起こされる血清学的反応と区別がつきませんが、ワクチン接種によって脳脊髄液に対する抗体が生成されることは通常ありません。
過去25年間で、狂犬病が「回復」した症例が明確に記録されているのはわずか7例です。いずれの患者からも狂犬病ウイルスは分離されませんでしたが、血清検体中の狂犬病中和抗体の高力価と脳脊髄液中の中和抗体の存在は、診断を強く裏付けました。
どのようなテストが必要ですか?
差動診断
ヒトの狂犬病の診断は通常、疫学的および臨床的データに基づいて行われ、検査室で確定診断されます。動物咬傷歴があり、あらゆる症状と徴候が現れている場合は、診断は容易です。そうでない場合は、特定の検査を行う前に、あまり典型的ではない症例の疫学的および臨床的特徴を慎重かつ迅速に評価する必要があります。神経学的徴候や症状、あるいは原因不明の脳炎を呈する患者は、居住国内外の狂犬病流行地域で動物との接触があった可能性について問診を受ける必要があります。米国で最近発生した数件のヒト死亡例において狂犬病が疑われなかったのは、接触歴の綿密な調査が不足していたためと考えられます。
狂犬病は発症時に、多くの感染症および非感染症に類似した症状を呈することがあります。ヘルペスウイルスやアルボウイルスによって引き起こされる脳炎など、他の多くの脳炎も狂犬病に類似しています。また、破傷風、脳マラリア、リケッチア症、腸チフスなどの感染症も狂犬病に類似することがあります。狂犬病と混同される可能性のある麻痺性感染症には、ポリオ、ボツリヌス中毒、サルヘルペスB脳炎などがあります。
狂犬病と混同される可能性のある非感染性疾患には、急性炎症性多発神経炎(ギラン・バレー症候群)をはじめとする多くの神経症候群、狂犬病ワクチン接種後の神経組織への二次的なアレルギー性脳脊髄炎、中毒または薬物中毒、アルコール離脱、急性ポルフィリン症、狂犬病ヒステリーなどがあります。ギラン・バレー症候群は麻痺性狂犬病と誤診される可能性があり、その逆も同様です。
処理 狂犬病
狂犬病の治療法は未だ確立されていません。特異的な抗狂犬病免疫グロブリンと白血球インターフェロンの大量投与は効果がありません。患者の苦痛を軽減するために対症療法が行われます。この目的のために、患者は別の病棟または箱に収容され、外部環境の影響を制限する保護体制(騒音の低減、明るい光、空気の流れ)が整えられます。中枢神経系の興奮性を抑えるために、睡眠薬、抗けいれん薬、鎮痛剤が処方されます。水分バランスは正常化されます。
麻痺期には、心血管系と呼吸器系の活動を刺激する薬剤が処方されます。患者の完全な安静状態を維持しつつ、高圧酸素療法、脳低体温療法、人工呼吸器の使用が推奨されます。しかし、これらの治療法は実質的に効果がありません。最良の場合、患者の余命を数ヶ月延長することが可能です。予後は、脳幹の損傷の重症度と生命維持中枢の破壊によって決定されます。
防止
1885年にパスツールが初めて狂犬病ワクチンを開発し、狂犬病対策がはるかに効果的な時代が到来しました。今日では、狂犬病によるヒトの死亡率はほぼ100%ですが、曝露前および曝露後のワクチン接種によって完全に予防可能です。パスツールとその同僚はパリで個人用の犬へのワクチン接種を開始しましたが、日本で初めて犬の集団ワクチン接種が行われたのは1920年代初頭で、これが国家レベルでの狂犬病対策プログラムの最初の例となりました。1970年代に初めて開発された野生動物への経口ワクチン接種は、キツネ、アライグマ、スカンクなどの主要な陸生宿主において、狂犬病を効果的に制御することが繰り返し実証されています。[ 68 ] 保有動物集団への70%以上の狂犬病ワクチン接種率の継続的な実施は、最終的に保有種から狂犬病ウイルスを排除し、偶発的な宿主へのウイルスの拡散を防ぐことにつながります。[ 69 ]
系統発生データによると、リッサウイルスは陸生哺乳類に感染するずっと前からコウモリに感染しており、RABVを含むほとんどのリッサウイルスは、現在でも世界中の様々なコウモリ種の間で循環している。[ 70 ] しかし、コウモリ間でのRABVの伝播を防ぐ効果的な方法は未だ見つかっておらず、現時点で狂犬病を完全に根絶することは不可能である。しかし、狂犬病に感染した哺乳類に噛まれてRABVに曝露した後であっても、世界保健機関(WHO)の勧告に従って迅速に治療が行われれば、安全かつ効果的な曝露後予防(PEP、創傷洗浄、狂犬病免疫グロブリン、狂犬病ワクチン接種を含む)によってヒトを狂犬病感染から守ることができる。
ヒトの死亡を防ぐためのこれら2つの方法(一つは感染に曝露した人々へのワクチン接種に基づく方法、もう一つは感染源における感染サイクルを断ち切るのに十分な数の犬へのワクチン接種に基づく方法)は、犬狂犬病の予防と管理における「ワンヘルス」アプローチの基盤となる。ヒトの死亡を防ぐためのこれら2つの異なる手段は、ヒトへのPEP(予防的前頭葉ワクチン接種)に基づく戦略Aと、イヌへのワクチン接種に基づく戦略Bという別々の選択肢として検討された。また、代替戦略の想定コスト分析においては、戦略Aと戦略Bを組み合わせた戦略の構成要素として検討された。[ 71 ]
タイなどの国では、PEPの使用により人の死亡を防ぐことに大きな成功を収めてきましたが、PEPのみの使用に関連する需要と関連コストの増加も認識しています。 [ 72 ] 例えば、1991年の状況と比較すると、2003年には4倍の人数(40万人以上)がPEPを必要としました。最近のデータによると、中華人民共和国は、狂犬病の可能性のある曝露後に年間1500万人にワクチン接種を行い、PEPだけで年間約6億5000万米ドルを費やしています。 [ 73 ]
より持続可能なアプローチは、感染源である動物集団で感染拡大を防ぎつつ、必要に応じて感染に曝露したヒト患者へのPEP(予防的前処置)のアクセスを向上させることです。犬狂犬病を制御するための政治的意思と十分な資金があれば、死亡例を根絶することが可能であり、実際に根絶されています。犬用ワクチンの普及により、1954年のマレーシア、[ 74 ] 1956年の日本、1961年の台湾、シンガポール、そして特に西ヨーロッパ全域を含むいくつかの国で犬狂犬病が根絶されました(Rupprecht et al、King et al、Gongal and Wrightによるレビュー)。[ 75 ]
Использованная литература



 [
[