T細胞リンパ腫は高齢者に最も多く見られますが、小児にも散発的に見られる症例があります。男性は女性の2倍の割合で発症します。T細胞リンパ腫は表皮向性です。
原因 皮膚のT細胞リンパ腫
皮膚T細胞リンパ腫の原因と病態は完全には解明されていません。現在、多くの研究者は、ヒトT細胞白血病ウイルス1型(HTLV-1)Iが皮膚悪性T細胞リンパ腫の発症を引き起こす主な病因であると考えています。これに加えて、エプスタイン・バーウイルスや単純ヘルペス6型といった他のウイルスがT細胞リンパ腫の発症に関与していることも議論されています。T細胞リンパ腫の患者では、皮膚、末梢血、ランゲルハンス細胞にウイルスが存在します。菌状息肉症の多くの患者では、HTLV-Iに対する抗体が検出されます。
T 細胞リンパ腫の発症において、皮膚の免疫病理学的プロセスが重要な役割を果たしており、その主なものはクローンリンパ球の制御不能な増殖です。
リンパ球、上皮細胞、マクロファージ系細胞によって産生されるサイトカインは、炎症誘発作用および増殖作用を有します(IL-1:リンパ球分化を担う、IL-2:T細胞増殖因子、IL-4およびIL-5:病変部への好酸球の流入増加と活性化など)。Tリンパ球の病変部への流入の結果、ポトリエ型微小膿瘍が形成されます。リンパ球増殖の増加と同時に、抗腫瘍防御細胞(ナチュラルキラー、リンパ球傷害性リンパ球、樹状細胞、特にランゲルハンス細胞)、そして腫瘍増殖抑制因子であるサイトカイン(IL-7、IL-15など)の活性が抑制されます。遺伝的要因の影響も否定できません。家族性症例の存在、いくつかの組織適合性抗原(悪性度の高い皮膚リンパ腫ではHLA B-5およびHLA B-35、それほど攻撃的ではないリンパ腫ではHLA A-10、菌状息肉腫の紅皮症ではHLA B-8)の頻繁な検出により、皮膚疾患の遺伝性が確認されます。
臨床観察は、長期にわたる慢性皮膚疾患(神経性皮膚炎、アトピー性皮膚炎、乾癬など)が菌状息肉症へと転化する可能性があることを示唆しています。鍵となる要因は、炎症巣におけるリンパ球の長期にわたる残存です。これにより免疫監視が阻害され、悪性リンパ球のクローンの出現が促進され、悪性増殖プロセスの発症につながります。
日射、電離放射線、化学物質などの物理的要因が身体に及ぼす影響により、「遺伝的外傷」リンパ球のクローンが出現し、リンパ球細胞に変異を引き起こし、リンパ球の悪性腫瘍を発症する可能性があります。
したがって、T細胞リンパ腫は、様々な発癌性因子、すなわち「遺伝的外傷性」因子の影響下でのリンパ球の活性化と、優勢なT細胞クローンの出現から始まる多因子疾患と考えることができます。免疫監視障害の重症度、すなわち悪性リンパ球クローンの出現が、T細胞リンパ腫の臨床症状(斑点状、プラーク状、または腫瘍要素)を決定します。
病因
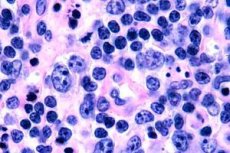
菌状息肉腫の初期段階では、幅広い突起を伴う表皮肥大、基底角化細胞の増殖と緻密化、一部の基底細胞の空胞変性、表皮の様々な層における異型有糸分裂、表皮へのリンパ球の浸潤を伴う浸潤細胞の表皮向性が観察されます。真皮では、血管周囲に、濃染した核を持つ単核細胞(「真菌性」細胞)からなる小さな浸潤が観察されます。第2段階では、真皮浸潤の重症度が上昇し、浸潤細胞の表皮向性が観察されます。その結果、悪性リンパ球が表皮に浸潤し、ポトリエ微小膿瘍の形でクラスターを形成します。 3番目の腫瘍期では、表皮の広範な棘細胞腫と軽度の萎縮が観察されるほか、腫瘍リンパ球の表皮への浸潤が増強し、多数のポトリエ微小膿瘍を形成します。この広範な浸潤は真皮の全層に広がり、皮下組織の一部を覆います。芽球状のリンパ球が観察されます。
皮膚大型未分化T細胞リンパ腫
これは、非定型クローン性の大型未分化CD30陽性T細胞からの増殖細胞の存在を特徴とするリンパ増殖性プロセス群として代表されます。通常、菌状息肉症の腫瘍期またはセザリー症候群において二次的に発生しますが、単独で発生する場合や、この種の全身性リンパ腫の播種性転移に伴って発生する場合もあります。臨床的には、このようなリンパ腫は、いわゆる断頭型菌状息肉症に相当し、単一または複数のリンパ節が通常は集塊を形成します。
組織学的には、表皮萎縮の場合、増殖物は表皮向性の有無にかかわらず真皮のほぼ全体を占めます。
細胞学的には、腫瘍細胞の大きさや形状は様々です。これらの特性に基づき、中細胞多形性T細胞リンパ腫と大細胞多形性T細胞リンパ腫に分類されます。これらのリンパ腫は、核が様々な不規則な形状(湾曲状、多葉状、高密度クロマチン、明瞭な核小体、比較的豊富な細胞質)を示す場合と、免疫芽球性(大きな円形または楕円形の核、明瞭な核質、中央に核小体を有する場合)を示す場合と、退形成性(醜い非常に大きな細胞、不規則な核形状、豊富な細胞質)を示す場合があります。表現型的には、このグループ全体がTヘルパーリンパ腫に属し、CD30陽性またはCD30陰性の場合があります。
R. Willemzeら(1994)は、CD30陽性リンパ腫の経過はより良好であることを示した。遺伝子型的には、Tリンパ球受容体のクローン性再編成が検出される。
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
症状 皮膚のT細胞リンパ腫
皮膚T細胞リンパ腫の中で最も多くみられる疾患は菌状息肉症で、症例の約70%を占めます。この疾患には、古典型、紅皮症型、頭蓋型という3つの臨床型があります。T細胞リンパ腫は、斑点、プラーク、腫瘍といった発疹の多型性が特徴です。
菌状息肉症の紅皮症型は、通常、抑えきれない痒み、腫脹、全身の充血、体幹および四肢の皮膚における紅斑性扁平上皮病変の出現から始まり、これらは1~2ヶ月以内に融合して紅皮症を発症する傾向があります。ほぼすべての患者に、手掌足底角化症と皮膚全体のびまん性薄毛が認められます。すべてのリンパ節群が大きく腫大します。腫大した鼠径部、大腿部、腋窩部、肘部のリンパ節は、周囲の組織と癒着しておらず、痛みを伴わない、緻密で弾力のある「塊」として触知されます。全身状態は急激に悪化し、38~39℃の発熱、寝汗、脱力感、体重減少がみられます。現在、多くの皮膚科医は、セザリー症候群を菌状息肉症の紅皮症型の中で最もまれな白血病型と考えています。
リンパ球造影では、顕著な白血球増多が認められます - セザリー細胞。セザリー細胞は悪性のT細胞ヘルパーで、核は大脳様の襞状表面を呈し、核膜は深く陥入しています。2~5年後には致死的な転帰が認められ、その原因として心血管疾患や中毒がよく挙げられます。
菌状息肉腫の断頭型は、一見健康な皮膚に、長期間のプラーク形成を経ずに腫瘍様病変が急速に出現することを特徴とします。この病型は悪性度が高く、リンパ肉腫の兆候と考えられています。1年以内に致死的な転帰が見られます。
ステージ
菌状息肉腫の典型的な形態は、紅斑扁平上皮、プラーク、腫瘍という 3 つの発達段階を特徴とします。
第一段階は、湿疹、脂漏性皮膚炎、尋常性乾癬といった良性の炎症性皮膚疾患の臨床像に類似しています。この段階では、様々な大きさの斑点が観察されます。濃いピンク色、紫がかったピンクレッド、輪郭は円形または楕円形で比較的明確な境界があり、表面はふすま状または薄片状の剥離です。これらの斑点は皮膚の様々な部位に現れることが多く、最も多いのは体幹と顔面です。徐々に、その数は増加します。時間の経過とともに、このプロセスは紅皮症(紅皮症期)の特徴を帯びるようになります。発疹は何年も続く場合もあれば、自然に消失する場合もあります。良性の炎症性皮膚疾患とは異なり、この段階の発疹や痒みの要素は治療に抵抗性です。
浸潤性プラーク期は数年かけて進行します。以前の斑点状の発疹の代わりに、丸いまたは不規則な輪郭を持つプラークが現れます。色は濃い紫色で、健康な皮膚とは明確に区別でき、表面は薄片状で、密度が高く、厚みがあります。その性状は「厚紙」に似ています。プラークの一部は自然に消失しますが、暗褐色の色素沈着や萎縮(多形皮膚萎縮)の領域が残ります。この段階では、掻痒感はさらに強くなり、痛みを伴い、発熱や体重減少が見られます。リンパ節腫脹が認められる場合もあります。
3番目の腫瘍段階では、プラークから発生するか、一見健康な皮膚に発生する、高密度で弾力性のある黄赤色の痛みのない腫瘍が現れます。腫瘍の形は球形または平らで、キノコの傘に似ていることがよくあります。腫瘍はどこにでも発生する可能性があります。その数は1個から数十個まで幅広く、サイズは直径1cmから20cmです。長期にわたる腫瘍が崩壊すると、縁が不均一で底が深い潰瘍が形成され、筋膜または骨に達します。リンパ節、脾臓、肝臓、肺が最も影響を受けます。全身状態が悪化し、中毒症状が現れて増加し、衰弱が生じます。診断時からの古典的な菌状息肉症患者の平均余命は5年から10年です。死亡率は通常、併発疾患(肺炎、心血管不全、アミロイドーシス)によって観察されます。主観的にはかゆみを感じ、腫瘍が崩壊すると患部に痛みが生じます。
何を調べる必要がありますか?
どのように調べる?
どのようなテストが必要ですか?
処理 皮膚のT細胞リンパ腫
紅斑扁平上皮癌の段階では、抗腫瘍療法は不要です。局所コルチコステロイド(プレドニゾロン、ベタメタゾン、デキサメタゾン誘導体)、インターフェロンα(1日300万IU、その後は臨床症状や治療効果に応じて週3回、3~6ヶ月間)、インターフェロンγ(1日10万IUを10日間投与し、10日間の休薬期間を挟んで12~3サイクルを繰り返す)、PUVA療法またはRe-PUVA療法が処方されます。PUVA療法の有効性は、増殖中のヘルパーT細胞において、ソラレンとDNAが選択的に共有結合し、細胞の分裂を阻害することに基づいています。第2段階では、上記の薬剤に加えて、全身性コルチコステロイド(プレドニゾロン30~40mg/日を1.5~2ヶ月間投与)と細胞増殖抑制剤(プロスペジン100mg/日を毎日、合計4~5回注射)が使用されます。インターフェロンを他の治療法と併用することで、より顕著な治療効果が得られます(インターフェロン+PUVA療法、インターフェロン+細胞増殖抑制剤、インターフェロン+芳香族レチノイド)。
腫瘍期には、多剤併用化学療法が主な治療法です。ビンクリスチン(0.5~1mgを1日1回静脈内投与、計4~5回)とプレドニゾロン(化学療法中は1日40~60mgを経口投与)、プロスピジン(1日100mgを計3g)、インターフェロンを併用します。光線力学療法、電子線療法、フォトフェレシス(体外光化学療法)が推奨されます。


