
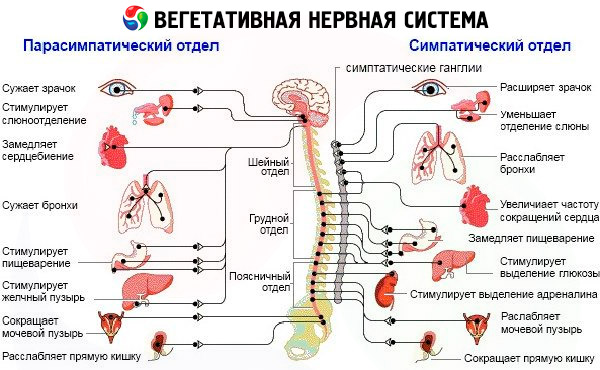
自律神経系を研究する際には、その機能状態を判断することが重要です。研究の原則は、臨床的および実験的アプローチに基づく必要があり、その本質は、緊張、自律神経反応、および自律神経活動支援の機能的および動的研究です。自律神経の緊張と反応は、身体の恒常性維持能力のアイデアを提供し、自律神経活動支援は適応メカニズムのアイデアを提供します。自律神経障害がある場合は、それぞれの特定の症例で病変の病因と性質を明らかにする必要があります。自律神経系の損傷レベルを決定します:上節性、節性。脳構造の主な関心:LRC(鼻脳、視床下部、脳幹)、その他の脳構造、脊髄。副交感神経と交感神経の栄養形成 - 交感神経鎖、神経節、神経叢、副交感神経節、交感神経と副交感神経の線維、つまりその節前と節後の部分の損傷。
栄養音の研究
栄養状態(初期)の調子とは、「相対的休息」、すなわちリラックスした覚醒状態における栄養状態の指標の状態の、多かれ少なかれ安定した特徴を指します。代謝バランスを維持する調節装置、つまり交感神経系と副交感神経系の関係が、調子の提供に積極的に関与しています。
研究方法:
- 特別アンケート
- 客観的な栄養指標を記録した表、
- 栄養状態の研究から得られたアンケート調査と客観的データの組み合わせ。
自律神経反応の研究
栄養反応性は、外的および内的刺激に反応して生じる栄養反応を特徴づける。反応の強さ(栄養指標の変動幅)とその持続時間(栄養指標が初期レベルに戻るまでの時間)が重要である。
栄養反応を研究する際には、「初期レベルの法則」を考慮する必要があります。これによれば、初期レベルが高いほど、システムまたは器官の活動性と緊張度が高くなり、妨害刺激に対する反応は小さくなります。初期レベルが急激に変化した場合、妨害因子は逆の符号を持つ「逆説的」または拮抗的な反応を引き起こす可能性があります。つまり、活性化の程度は刺激前のレベルと関係していると考えられます。
栄養反応を研究する方法:薬理学的 - アドレナリン、インスリン、メサトン、ピロカルピン、アトロピン、ヒスタミンなどの溶液の投与、物理的 - 寒冷および温熱テスト、反射ゾーン(圧力)への影響:眼心臓反射(Dagnini - Aschner)、洞頸動脈反射(Tschermak、Hering)、太陽反射(Thomas、Roux)など。
薬理学的試験
アドレナリンおよびインスリンを用いた試験の実施方法。試験は午前中に実施する。被験者は水平姿勢で15分間の休息後、血圧、心拍数などを測定する。その後、0.1%アドレナリン溶液0.3 ml、または0.15 U/kgの用量のインスリンを肩の皮下に注射する。アドレナリン注射後3、10、20、30、40分に血圧、脈拍、呼吸数を記録し、インスリン投与後は1.5時間にわたり10分ごとに同じ指標を記録する。10 mmHgを超える変動は収縮期血圧および拡張期血圧の変化、1分間に8~10拍以上の増減は心拍数の変化、1分間に3回以上の呼吸数の変化は呼吸数の変化とみなした。
サンプルの評価。自律神経反応は、正常、増加、減少の3段階に分類されました。健常者群では、以下の結果が認められました。
- 検査を受けた人の3分の1に薬物投与に対する反応が見られなかった。
- 部分的(弱い)自律神経反応。1つまたは2つの客観的指標(血圧、脈拍、呼吸)の変化を特徴とし、時には軽い主観的感覚を伴う、または主観的感覚を伴わずに3つの客観的指標に変化がみられる(検査対象者の3分の1に発生)。
- 検査対象者の 3 分の 1 に、記録された 3 つの客観的指標すべてに変化があり、主観的な訴え(動悸、悪寒、内部の緊張感、または逆に脱力感、眠気、めまいなど)も現れる、顕著な(増加した)栄養反応が見られました。
自律神経系の変化と主観的感覚の性質に応じて、交感神経副腎性、迷走神経島状、混合性、および二相性反応が区別されます (後者の場合、最初の段階は交感神経副腎性で、2 番目の段階は副交感神経性、またはその逆になります)。
身体活動
コールドテストの実施方法。血圧と心拍数は、仰臥位で測定します。被験者は、もう一方の手を+4℃の水に手首まで浸し、1分間そのまま保持します。血圧と心拍数は、手を水に浸した直後、0.5分後、1分後に記録し、その後、手を水から引き上げた後、血圧と心拍数が初期値に戻るまで記録します。心拍数を心電図で測定する場合は、指定された時間間隔におけるR波またはRR間隔の数をカウントし、1分間の心拍数に再計算します。
試験評価。正常な栄養反応は、収縮期血圧が0.5~1分後に20mmHg、拡張期血圧が10~20mmHg上昇することを示している。血圧の最大上昇は冷却開始後30秒後である。血圧が初期レベルに戻るのは2~3分後である。
病理学的逸脱:
- 血管運動神経の過剰興奮(過敏性) - 収縮期血圧と拡張期血圧の大幅な上昇、すなわち顕著な交感神経反応(自律神経反応の増加)
- 血管運動神経の興奮性の低下(活動性低下) - 血圧のわずかな上昇(拡張期血圧の上昇が10 mmHg未満)、交感神経反応の弱化(自律神経反応の低下)。
- 収縮期血圧と拡張期血圧の低下 - 副交感神経反応(または異常な反応)。
反射区への圧力
眼心臓反射(ダグニーニ・アシュナー法)。検査方法:15分間安静に臥位した後、1分間心電図を記録し、続いて1分間心拍数を計測する(初期背景)。次に、両眼球を指先で圧迫し、軽い痛みを感じるまで圧迫する。Barre眼圧計(圧迫圧300~400g)を使用することもできる。圧迫開始から15~25秒後、心電図を用いて10~15秒間心拍数を記録する。10秒間のR波数を計測し、1分間のR波数を再計算する。
圧迫が解除されてから1~2分後に心拍数を記録することも可能である。この場合、心拍数は、眼球への圧迫開始前の10秒間のRR間隔を5回計測し、その平均値に対する、圧迫終了時の最後の10秒間のRR間隔の増加率として算出される。
心拍数は、心電図記録からではなく、30秒間10秒ごとに触診することで計算することもできます。
解釈: 心拍数の正常な低下 - 正常な自律神経反応。強い低下 (副交感神経、迷走神経反応) - 自律神経反応の増加。弱い低下 - 自律神経反応の低下。低下なし - 異常な自律神経反応 (交感神経反応)。
通常、圧迫開始から数秒後、心拍数は1分間に6~12拍減少します。心電図では洞調律の緩徐化が示されます。
すべての検査評価は、反応の強さと性質の両方を示します。しかし、健康な被験者の検査で得られたデジタルデータは、おそらく様々な理由(初期心拍数の違い、記録・処理方法の違い)により、異なる著者間で同じではありません。初期心拍数の違い(1分間に70~72回程度)により、ガリュ式を用いて計算することが可能です。
X = HRsp/HRsi × 100、
ここで、HRsp はサンプル内の心拍数、HRsi は初期心拍数、100 は従来の HR 数です。
ガルの式によれば、脈拍の減速は 100 - X に等しくなります。
M±aの値を基準値とするのが適切であると考えています。ここで、Mは試験群における1分間の心拍数の平均値、oはMからの標準偏差です。値がM+gよりも高い場合は、自律神経反応(交感神経または副交感神経)の亢進とみなすべきであり、値がM+gよりも低い場合は、自律神経反応の減少とみなすべきです。他の自律神経反応検査においても、この方法で計算を行う必要があると考えています。
健康な人の心拍数サンプルの研究結果
試す |
マア |
眼心臓反射 |
-3.95 ± 3.77 |
頸動脈洞反射 |
4.9 ± 2.69 |
太陽反射 |
-2.75 ± 2.74 |
頸動脈洞関節反射(Tschermak-Gering)。検査方法:15分間の順応(安静)後、臥位で1分間の心拍数(ECG記録 - 1分)を初期背景として計測します。次に、頸動脈の脈動が感じられるまで、交互に(1.5~2秒後)人差し指と親指で胸鎖乳突筋の上部3分の1の領域を下顎角のわずかに下の領域に押します。刺激の影響は左側よりも右側の方が強いため、右側から圧迫を開始することをお勧めします。圧迫は痛みを引き起こさない程度に軽く、15~20秒間行います。15秒目から、10~15秒間ECGを使用して心拍数を記録し始めます。次に圧迫を止め、ECGのR波の周波数に基づいて1分あたりの心拍数を計算します。眼球運動反射の研究と同様に、RR間隔に基づいて計算することができます。また、圧迫停止後3分および5分における後遺症の状態を記録することもできます。場合によっては、血圧と呼吸数も記録されます。
解釈: 健康な被験者から得られた値は、心拍数の正常な変化、つまり正常な自律神経反応であると考えられます。
この値を超えると、自律神経反応の亢進、すなわち副交感神経活動の亢進または交感神経活動の不足を示し、この値を下回ると自律神経反応の亢進を示します。心拍数の増加は、反応の歪みを示しています。他の研究者(Rusetsky II, 1958; Birkmayer W., 1976、他)によると、正常範囲は心拍数が10秒後に1分間に12回まで低下し、血圧が10mmまで低下し、呼吸数が低下し、場合によっては心電図上のT波が少なくとも1mm増加すると考えられています。
病理学的異常:血圧低下を伴わない心拍数の突然かつ顕著な低下(迷走心臓型)、脈拍低下を伴わない血圧の急激な低下(10mmHg以上)(降圧型)、血圧や脈拍の変化を伴わない、またはこれらの指標の変化を伴うめまい、失神(脳型)、血圧上昇 [Birkmayer W., 1976]。したがって、M±aの値を計算することが推奨されます。
太陽反射 - 心窩部反射(トーマ、ルー)。検査方法:安静時、仰臥位で腹筋を弛緩させた状態で、検査前に心電図を記録し(背景検査)、心拍数は心電図のRR間隔から測定します。動脈圧も測定できます(初期背景検査)。腹部大動脈の脈動が感じられるまで、手で太陽神経叢を圧迫します。
圧迫開始から20~30秒後に、心電図を用いて10~15秒間心拍数を再度記録します。心拍数は、心電図上の10秒間のR波の数に基づいて算出し、1分ごとに再計算します。心拍数は、眼球運動反射の検査と同様に、RR間隔に基づいて算出できます(上記参照)。
解釈:M±oの値を基準値とする。反応の発現度合い(正常、増加または発現、減少および異常)と反応の性質(交感神経性、迷走神経性、副交感神経性)を判定する。
II Rusetsky (1958)、W. Birkmayer (1976) によれば、いくつかの種類の反応が指摘されています。
- 反射が欠如または反転している(脈拍が十分に遅くなったり速くなったりしない) - 交感神経型の反応。
- 陽性反射 - 1 分あたり 12 心拍以上遅くなる - 副交感神経型;
- 1分あたり4~12拍の減速 - 正常タイプ。
反応性試験では、自律神経系の緊張に関する研究で示された係数を計算することができます。試験で得られた結果は、自律神経系の反応、すなわち交感神経系と副交感神経系の反応性の強さ、特徴、持続時間に関する知見を提供します。
活動の栄養サポートの研究
様々な活動形態における栄養的支援の研究は、栄養神経系の状態に関する重要な情報も提供します。なぜなら、栄養的要素はあらゆる活動に必須の要素だからです。私たちは、これらの要素を記録することを「活動における栄養的支援の研究」と呼んでいます。
栄養サポート指標は、行動の適切な栄養サポートを判断することを可能にします。通常、栄養サポート指標は行動の形態、強度、持続時間と厳密に相関しています。
活動の栄養的サポートを研究する方法
臨床生理学では、活動の実験モデル化を使用して栄養サポートの研究が行われます。
- 身体 - 適量の身体活動:自転車エルゴメトリー、適量のウォーキング、一定時間内に一定回数30〜40°の水平姿勢で脚を上げる運動、2段階マスターテスト、適量のスクワット、10〜20kgまでのダイナモメーターベンチプレスなど。
- 位置テスト - 水平位置から垂直位置への移行、およびその逆(オルソクリノスタティックテスト)
- メンタル - 暗算(単純 - 200 から 7 を引く、複雑 - 2 桁の数字を 2 桁の数字で掛ける)、単語の作成(たとえば、7 つの文字で 7 つの単語など)。
- 感情的 - 否定的な感情のモデリング:電気ショックの脅威、過去に経験した否定的な感情的状況の再現、または病気に関連する否定的な感情の特別な誘導、クルト・ルーヴィン法を使用した感情的ストレスの誘導など。さまざまな方法での肯定的な感情のモデリング、たとえば、病気の良好な結果について話すなど。栄養シフトを記録するために、次のパラメーターが使用されます:心血管系:心拍数、PC変動、血圧、REG指標、プレチスモグラフィーなど。呼吸器系 - 呼吸数など。皮膚電気反射(GSR)、ホルモンプロファイル、およびその他のパラメーターが調査されます。
研究対象パラメータは、安静時(初期自律神経緊張)および活動時に測定されます。この期間中のパラメータの増加は、II自律神経活動支持として評価されます。解釈:得られたデータは、正常な自律神経活動支持(変化は対照群と同じ)、過剰(変化は対照群よりも強い)、不十分(変化は対照群よりも顕著でない)として解釈されます。
活動は主にエルゴトロピックシステムによって提供されるため、エルゴトロピック装置の状態は初期データからの逸脱度によって判断されました。
オルソクリノスタティック試験における栄養支持に関する研究。この試験は多くの著者によって報告されており(Rusetsky II, 1958; Chetverikov NS, 1968 他)、シェロン血行動態試験に基づいていくつかの改良が加えられています。ここではそのうちの2つの変種についてのみ説明します。最初の変種(古典的)はW. Birkmayer (1976) のマニュアルに記載されています。2つ目の変種は、私たちが最近採用しているもので、Z. Servit (1948) が提案した方法を用いて試験を実施し、得られた結果を処理するものです。
私たちは、ターンテーブルを使用せずに能動的に実施されるオルソクリノスタティックテストを、血行動態テストとしてだけでなく、活動の自律神経サポート、つまり、ある姿勢から別の姿勢への移行と、その後の新しい姿勢の維持を確実にする自律神経シフトのテストでもあると考えています。
第一の変法。安静時および水平姿勢で、心拍数と血圧を測定します。その後、患者は不必要な動きをせずにゆっくりと立ち上がり、ベッド近くの楽な姿勢で立ちます。直ちに垂直姿勢になり、脈拍と血圧を測定し、その後10分間、1分間隔で繰り返します。被験者は3分から10分間、垂直姿勢を維持できます。検査終了時に病的な変化が認められた場合は、測定を継続する必要があります。患者は再び横になってもらいます。横になった直後、血圧と心拍数が初期値に達するまで、1分間隔で測定します。
解釈。正常な反応(活動の正常な自律神経サポート):立ち上がるとき - 収縮期血圧が一時的に20 mmHgに上昇し、拡張期血圧もそれほど上昇せず、一時的に心拍数が1分あたり30回に増加します。立ち上がる際、収縮期血圧は低下することがあり(初期値より15 mmHg低下するか変化なし)、拡張期血圧は変化なしまたはわずかに上昇するため、初期値に対する圧力振幅が減少することがあります。起立中の心拍数は、初期値に対して1分あたり40回に増加することがあります。最初の姿勢(水平)に戻ると、動脈圧と心拍数は3分以内に初期値に戻ります。横になった直後に、一時的に圧力が上昇することがあります。主観的な訴えはありません。
活動の栄養サポートの違反は、次の症状によって現れます。
- 収縮期血圧が20 mmHg以上上昇する。
- 拡張期血圧も上昇しますが、収縮期血圧よりも大幅に上昇する場合もありますが、低下したり同じレベルに留まる場合もあります。
- 立ち上がる際に拡張期血圧のみが独立して上昇する。
- 立ち上がったときの心拍数が1分あたり30回以上増加する。
- 立ち上がるときに、頭に血が上ったり、視界が暗くなったりするのを感じることがあります。
上記のすべての変化は、過剰な栄養補給を示しています。
- 起立直後に収縮期血圧が一時的に10~15mmHg以上低下する。同時に拡張期血圧が上昇または低下することもあり、その結果、圧振幅(脈圧)が著しく低下する。訴え:起立時のふらつきと脱力感。これらの現象は、栄養補給が不十分であると解釈される。
- 立位時、収縮期血圧は初期値より15~20mmHg以上低下します。拡張期血圧は変化しないかわずかに上昇しますが、これは低張性調節障害であり、適応障害の一つである自律神経機能不全とみなすこともできます。拡張期血圧の低下(W. Birkmayer, 1976による低力学的調節)も同様に考えられます。動脈圧の振幅が初期値と比較して2倍以上低下した場合は、調節障害だけでなく、私たちの見解では自律神経機能障害も示唆します。
- 起立時に心拍数が1分間に30~40回以上増加し、血圧が比較的変化しない場合は、過剰な自律神経機能亢進(W. Birkmayer, 1976による頻脈調節障害)と診断されます。起立性頻呼吸が生じることもあります。
起立性調節試験中の心電図変化:洞脈拍数の増加、II誘導およびIII誘導におけるP波の増加、ST間隔の減少、II誘導およびIII誘導におけるT波の平坦化または陰性化。これらの現象は、起立直後または長時間の立位中に発生する可能性があります。起立性調節変化は健常者にも観察されます。これは心臓の欠陥を示すものではなく、交感神経緊張(過剰供給)に関連する栄養供給の異常です。
横臥姿勢に移行する場合と横臥姿勢をとる場合のルールは同じです。
第2の変法。水平姿勢で15分間安静にした後、被験者の動脈圧を測定し、心拍数を1分間ECGで記録して記録します。被験者は静かに垂直姿勢まで立ち上がります。これには約8~10秒かかります。その後、再び垂直姿勢でECGを1分間連続記録し、動脈圧を記録します。次に、3分目と5分目にECGを20秒間記録し、ECG記録後同じ時間間隔で動脈圧を測定します。その後、被験者は横になり(クリノスタティックテスト)、上記の方法に従って同じ時間間隔で同じ栄養指標を再び記録します。心拍数は、ECGの10秒間隔でR波をカウントすることにより記録されます。
起立性試験および傾斜試験の1分間隔で得られたデータは、Z. Servit (1948) に基づいて処理されます。以下の指標が算出されます。
1. 1分間の平均起立性加速度(AOA)。これは、1分間の最初の10秒間、2秒目、6秒目における心拍数の増加量の合計を3で割った値です。
SOU = 1 + 2 + 6 / 3
起立性不安定指数 (OLI) は、起立姿勢での 1 分間の最高心拍数と最低心拍数の差 (最初の 1 分間の 10 秒間隔 6 回から選択) であり、起立性テストにおける心拍数変動の最小範囲です。
クリノスタティック減速(CD)とは、垂直姿勢から横臥位に移行した後、1 分以内に心拍数が最大に減速する現象です。
オルソクリノスタティック差 (OCD) は、オルソスタティック テストとクリノスタティック テスト中の最大加速度と最大減速度の差です (テストの 1 分間に 10 秒間隔を 6 回実行して計算も行われます)。
クリノスタティック不安定指数(CIL)は、クリノスタティック試験(水平姿勢で1分間、10秒間隔で選択)中の心拍数の最大低下と最小低下の差です。計算はすべて立位および臥位で1分以内に実施され、その後、3分目と5分目の心拍数および血圧値が算出されます。指定された試験の異なる時間間隔で健常被験者から得られたM±aの値が基準値として採用されます。
自律神経系の状態を動的に研究することで、初期の自律神経緊張(末梢自律神経形成の状態によって決まる)、自律神経反応、および活動に対する自律神経サポート(適応行動を組織する脳の超節系の状態によって決まる)についての知見が得られます。
安静時および負荷時の自律神経系の状態を特徴付けるために特定のパラメータを記録する臨床医に広く使用されている上記の機能動的方法に加えて、脈拍血液充填量、主要血管の血管壁の状態、血流の相対速度、動脈循環と静脈循環の関係に関する間接的な情報を提供するREGが使用されます。同じ問題はプレチスモグラフィーの助けを借りて解決されます。振動の増加、つまり血管拡張は交感神経の影響の減少として評価され、振動の減少、つまり収縮傾向はそれらの増加として評価されます。超音波ドップラーグラフィー(USDG)は血管床の状態を示し、これは自律神経系の状態も間接的に反映します。
神経筋興奮性の研究
最も一般的に使用される客観的なテストは次のとおりです。
安静時および5分間の過換気後にChvostek症状を誘発する。Chvostek症状の誘発は、口角と耳たぶを結ぶ正中線上の点を神経ハンマーで叩打することにより行う。発現の程度は以下のように測定する。
- I 度 - 唇交連の縮小;
- II度 - 鼻翼の縮小の追加;
- III 度 - 上記の現象に加えて、眼輪筋が収縮します。
- グレード IV - 顔の半分全体の筋肉が急激に収縮します。
5分間の過換気は、明らかに症状の発現レベルを増加させる[Аlаjouianine Th. et al., 1958; Klotz HD, 1958]。健常者では、Chvostek症状陽性は3~29%の症例で認められる。神経性テタニーでは、73%の症例で陽性となる。
カフテスト(トルソー症状)。方法:動脈止血帯または空気圧カフを患者の肩に5~10分間装着する。カフ内の圧力は、患者の収縮期血圧より5~10mmHg高い値に維持する。虚血後期に圧迫を解除すると、「産科医の手」現象と呼ばれる手足の痙攣が生じる。テタニーにおけるトルソー症状の出現頻度は15~65%で、末梢神経筋の興奮性が高いことを示す。
トルソー・ボンスドルフ試験。手順:患者の肩に空気圧カフを装着し、患者の収縮期血圧より10~15mmHg高い圧力を10分間維持する。これにより、腕の虚血が生じる。虚血期の後半には、5分間の過換気(1分間に18~20回の頻度で最大限に深く吸気および呼気を行う)を加える。試験結果:弱陽性:特に第一指節間隙領域における骨間筋の目に見える線維束性収縮の出現、手の形状の変化(「産科医の手」の形成傾向)。陽性:顕著な手足の痙攣像。陰性:上記の現象が認められない。
筋電図検査。筋電図検査では、強直性痙縮に関与する筋の特定の種類の電気活動が記録されます。この活動は、125~250ppsの周波数で、短時間(4~8ms)に発生する連続的な電位(二重電位、三重電位、多重電位)によって特徴付けられます。このような電位やその他の筋電図上の現象は、誘発試験を用いた検査期間中に発生します。
神経筋の興奮性を明らかにする他の検査には、ベヒテレフ肘症候群、シュレジンジャー症状、筋ローラー症状などがありますが、情報量が少なく、あまり使用されていません。
過換気症候群の研究方法
- 多系統性の特徴を持つ主観的感覚(訴え)の分析および訴えと呼吸機能との関連性。
- 病気の発症中または発症時に呼吸器疾患が存在すること。
- 過換気テストの結果は陽性でした。
- 神経筋の興奮性を検査します。
- 5% の二酸化炭素を含む空気混合物を吸入するか、「袋」(紙またはポリエチレン)に息を吹き込んで自分の二酸化炭素を蓄積し、その助けによって過換気発作を止めることができる可能性があります。
- 患者は肺胞気中の低炭酸ガス血症と血液中のアルカローシスを患っています。
過換気テストのテクニック:患者は水平または半横臥位(椅子に座る)になります。1分間に16〜22回の速度で深呼吸を始めます。テストは、耐性に応じて3〜5分間続きます。過換気テストが陽性の場合、進行の2つのバリエーションがあります。最初のバリエーション:テスト中に、感情的、自律神経的、強直的、その他の変化が発生し、完了後2〜3分で消失します。2番目のバリエーション:過換気により自律神経発作が発生し、テスト中に始まり、終了後も続きます。テストから本格的な発作への移行は、最初に呼吸で観察され、被験者は過換気を止めることができず、頻繁かつ深く呼吸を続けます。呼吸困難には、自律神経障害、筋緊張性障害、感情障害が伴います。一般的に、テスト中に自発的に生じる感覚に似た主観的感覚が発生することは、過換気症候群の診断を確定するための肯定的な基準であると認められています。
50歳以上の方は、検査は慎重に行う必要があります。禁忌は高血圧、心臓および肺の病変の存在、重度の動脈硬化症です。
神経系の機能状態を研究するための追加の方法
感情的および個人的な特性の研究
栄養障害、特に脳レベルの栄養障害は、精神栄養障害です。したがって、栄養障害の場合、精神領域の検査が必要です。その研究方法の一つは、幼少期および現在の心理的トラウマの存在を示す詳細な精神病歴の調査です。感情障害の臨床分析は重要です。心理検査は、FBベレジナとMIミロシュニコフ(1976)によって改訂された多面的人格研究法(MIP)、スピルベルガー、アイゼンク、キャッテルのテスト、ロールシャッハ投影法、主題統覚検査(TAT)、未完成文テスト、ローゼンツヴァイクテスト(フラストレーションテスト)など、様々な方法を用いて行われます。栄養障害の研究において最も有益なテストは、MIP、スピルベルガー、キャッテルのテストです。
電気生理学的研究
EEG は、プロセスの位置や、場合によってはその性質 (てんかん性過同期性全般化放電) を明らかにするだけでなく、過換気、光、音刺激、感情的ストレス、精神的負荷など、さまざまな負荷によってモデル化される、睡眠中、リラックスした覚醒状態、緊張した覚醒状態における脳の非特異的活性化および非活性化システムの機能状態を研究するためにも使用されます。
非特異的な脳系を検査する最も一般的な方法は、脳波(EEG)、心電図(ECG)、大脳皮質活動(GSR)、筋電図(EMG)、呼吸数のポリグラフ記録です。これらの指標の変化は、上行性活性化系と下行性活性化系(Mi)の関係を反映しています。同期していない脳系(脳幹網様体)と同期している脳系(視床皮質系)の関係と状態は、EEGの視覚的およびコンピューター解析(a指数、現在の同期指数の計算など)によって判断されます。睡眠中は、EEGデータから、様々な睡眠段階の表現特性、潜伏期、睡眠周期、運動活動(SMA)に関する情報を得ることができます。
近年、コンピュータ技術の活用により、神経生理学的研究の可能性は飛躍的に高まりました。平均化法を用いることで、主に感覚刺激や運動刺激によって引き起こされる事象関連電位を自発性脳波から分離することが可能になりました。
したがって、体性感覚誘発電位の研究により、特異的および非特異的求心性システムのさまざまなレベルの機能状態を効果的かつ差別的に評価することが可能になります。
行動組織化メカニズムと効果器システムの研究により、自発運動の実行に関連し、行動組織化と意思決定の一般的なプロセスと、皮質運動ニューロンの活性化のより局所的なメカニズムの両方を反映する運動電位を記録することが可能になります。
偶発的負の偏差(CND)の登録は、指向性注意、動機付け、確率予測のメカニズムを研究するために使用され、これにより非特異的な脳システムの状態を評価することができます。
自発的脳波のスペクトル マップを作成することで、脳活動の局所的組織化のメカニズムの特徴を研究することができます。
高速フーリエ変換アルゴリズムを用いた圧縮スペクトル解析(CSA)は、脳波リズムのスペクトルパワーと様々な機能負荷に対する反応性を明らかにすることを可能にし、非特異的な脳システムの状態に関する情報も提供します。さらに、CSA脳波は、適応反応に関与する大脳半球間相互作用(大脳半球間非対称性)の性質を明らかにします。
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ]
ホルモンおよび神経体液機能の研究
栄養障害は、神経内分泌代謝障害と併発することがよくあります。これらの疾患は、神経伝達物質の媒介による神経ホルモンおよび神経体液の比率の変化に基づいており、これらの変化は身体の適応能力、および人間活動調節系と栄養調節系の状態を示す指標となります。
場合によっては、ホルモンプロファイルと神経体液性関係の両方を調べる必要があります:甲状腺機能(Iの複合放射性同位元素吸収法を用いた基礎代謝)、視床下部-下垂体-副腎皮質系の状態(血液と尿中のコルチコステロイドとその代謝物の測定)、卵巣機能の検査(直腸温度、瞳孔症状、CII、ホルモンプロファイル)、炭水化物、タンパク質、水-塩代謝など。
神経体液性関係の状態を研究するために、血液、尿、脳脊髄液中のカテコールアミン(アドレナリン、ノルアドレナリン、ドーパミン、DOPA およびその代謝物)、アセチルコリンおよびその酵素、ヒスタミンおよびその酵素(ジアミン酸化酵素)、尿中への 5-OIAC の排泄によるセロトニンのヒスタミンペキシ効果(HPE)を測定します。
同時に、これらの指標は、特異的および非特異的 LRK システムの状態、および中枢の人間活動性および栄養向性装置と末梢の栄養システムの反応を評価するために使用できます。
ナトリウム、カリウム、総カルシウム、無機リン、塩素、二酸化炭素、マグネシウムなどの体液性(電解質)検査は、潜在性神経性テタニーの特定に役立ちます。一価イオン(ナトリウム、カリウム)と二価イオン(カルシウム、マグネシウム)の比率を示す係数が測定されます。神経性テタニー症候群(NTS)は、主に正常カルシウム血症ですが、相対的に低カルシウム血症になる傾向があります。NTS患者では、一価イオンが二価イオンよりも優位であることを反映する係数が有意に増加します。
自律神経系の分節機能の研究
自律神経系の病理に関する現代教育の発展には、古い方法論的アプローチの見直しと新しい研究方法の開発が必要でした。今日開発されている方法には特別な要件が課せられています。自律神経系研究のための検査は、以下の要件を満たす必要があります。
- 自律神経機能障害に関する十分な情報(結果の定量的評価)
- 特異的であり、繰り返しの研究で再現性の高い結果が得られる(変動係数は20~25%を超えてはならない)。3)生理学的および臨床的に信頼できる(安全である)。
- 非侵襲的;
- 簡単に素早く実行できます。
これらの要件を満たすテストはまだほとんどありません。
心臓血管系、発汗運動系、瞳孔系における自律神経系の研究のために開発された方法は、他の方法よりも上記の要件をより高い程度に満たしているため、より迅速に臨床実践に導入されています。
分節性栄養障害の研究は、病変の局在だけでなく、末梢栄養形成の消失または刺激を示す症状も考慮して行う必要があります。可能であれば、それらの性質(交感神経性か副交感神経性か)を特定する必要があります。栄養弧の特定の部分の関心が求心性か遠心性かを明確にすることが望ましいです。
使用される方法のいくつかは、初期の栄養緊張、栄養反応、および活動の栄養サポートを記録して、超節栄養装置に関する情報を提供できます。さらに、栄養神経系の節部分の状態に関する情報を取得することも可能です。
心臓血管系
交感神経流出路の状態を判定する方法
- 垂直姿勢への移行に伴う血圧変化の測定。臥位と起立後3分間の収縮期血圧の差を計算します。
解釈: 収縮期血圧の低下が 10 mm Hg 以下の場合は正常な反応であり、輸出性血管収縮線維の健全性を示します。11 ~ 29 mm Hg の低下は境界反応です。30 mm Hg 以上の低下は病的な反応であり、輸出性交感神経不全を示します。
- 等尺性負荷中の血圧変化の測定。ダイナモメーターを用いて、片方の手の最大力を測定する。次に、患者に3分間、最大値の30%に相当する力でダイナモメーターを握らせる。ダイナモメーターを握ってから3分後の血圧と、負荷をかける前の安静時の血圧の差を計算する。
解釈: 拡張期血圧が 16 mm Hg 以上上昇した場合は正常反応、10 ~ 15 mm Hg 上昇した場合は境界反応、10 mm Hg 未満上昇した場合は病的な反応であり、流出性交感神経不全を示唆します。
- 輸出性血管収縮性交感神経線維の状態の評価。この目的のために、手または前腕の容積脈波記録に基づくいくつかの検査が用いられる。
- 精神的ストレス、痛みを伴う刺激、または突然の騒音は、通常、末梢血管収縮により手の血液量減少と動脈圧上昇を引き起こします。血液量と動脈圧に変化が見られない場合は、皮膚血管に向かう流出性交感神経線維の損傷を示唆します。
- バルサルバ法またはバラニーチェアを用いた回転試験では、通常、血管収縮の増強により血液充填量が減少します。血液充填量に変化が見られない場合は、交感神経性末梢血管収縮因子の障害が示唆されます。
- 鋭く深く息を吸うと、前腕の血管が反射的に収縮します。この検査では、脊髄反射に基づく反応が見られますが、その求心性伝導路は不明であり、流出性伝導路は交感神経性血管収縮線維で構成されています。この検査で血液量が減少しないことも、交感神経の流出不全を示唆しています。
- スクワット(腹臥位での受動的な脚上げ)中は、血管収縮の減少により血流量が増加します。骨格筋の血管につながる交感神経性血管収縮線維が損傷すると、血流量に変化は見られません。
上記の脈波記録法を用いた検査は、正常範囲と病態の明確な定量的境界がないため、一般診療での使用は限定的であることに留意すべきである。しかしながら、被験者群で得られた結果は対照群のデータと比較することができる。
- 薬理学的試験:
- 血漿ノルエピネフリン(NA)濃度の測定:血漿ノルエピネフリン濃度は、交感神経終末および副腎髄質からの放出によって維持されます。血液中に放出される神経伝達物質の量は交感神経活動に比例するため、血漿ノルエピネフリン濃度は交感神経活動の指標として使用できます。血漿ノルエピネフリン濃度の低下は、血液脳関門またはその他の膜を介したノルエピネフリンの取り込みや拡散の変化ではなく、血管内の交感神経流出性終末からの異常な放出によると考えられています。健康な人では、血漿ノルエピネフリン濃度は仰臥位では一定であり、垂直姿勢になると急激に増加します。自律神経系の中枢位では、人が垂直姿勢をとっても変化しない特定の血漿ノルエピネフリン濃度が存在します。末梢病変(交感神経節後ニューロン)では、仰臥位でノルエピネフリン濃度が急激に低下し、起立試験では上昇しません。したがって、節前病変と節後病変を鑑別することが可能です。
- チラミン試験:チラミンは、節後シナプス前小胞からノルエピネフリンとドーパミンを放出します。チラミン投与後に血漿中のノルエピネフリン(カテコールアミン)の増加が不十分な場合、節後ニューロンのノルエピネフリン放出能力の欠損、すなわち遠位節後交感神経障害が示唆されます。
- ノルエピネフリン試験:少量のノルエピネフリンを静脈内投与すると、健康な人では全身血圧の上昇を含む多くの心血管系への影響が起こります。自律神経障害のある患者の中には、シナプス前神経終末の破壊に伴ういわゆる脱神経過敏症により、過剰な血圧反応を示す人もいます。一方、完全な脱神経では、この試験において正常範囲よりも低い血圧反応を示します。
- アナプリリン試験:アナプリリン(0.2 mg/kg 以下)を静脈内投与しても心拍数の低下が見られない場合、心臓につながる交感神経が損傷していることを示します。
- 皮膚血管、横紋筋、汗腺に伝わる交感神経末梢神経の活動電位の記録。最新の微小電極技術を用いて、末梢自律神経のニューロン活動を記録し、様々な刺激に対する自律神経反応の潜伏期を決定し、遠心性交感神経線維に沿った興奮伝導速度を計算することができる、現代的な電気生理学的手法です。
副交感神経流出路の状態を判断する方法
- 起立時の心拍数の変化。健康な人では、起立時に心拍数は急激に増加し(15拍目以降に最大値が観測されます)、30拍目以降は低下します。15拍目におけるRR間隔と30拍目におけるRR間隔の比は、「30:15比」または「30:15係数」と呼ばれます。通常、この値は1.04以上です。1.01~1.03は境界値、1.00は心臓への迷走神経の作用が不十分であることを示します。
- 深くゆっくりとした呼吸中の心拍数の変化 - 1分間に6回。呼気時の最大延長RR間隔と吸気時の最大短縮RR間隔の比を測定します。健康な人では、迷走神経の影響による洞性不整脈のため、この比は常に1.21を超えます。1.11~1.20の指標は境界域です。洞性不整脈が軽減する、すなわち迷走神経不全症がある場合、この指標は1.10を超えることはありません。
- バルサルバ法中の心拍数の変化。バルサルバ係数を計算します。呼吸はマノメーターに接続されたマウスピースで行い、圧力は15秒間40 mmHgに維持されます。同時に、心拍数はECGを使用して記録されます。バルサルバ係数の計算:テスト後の最初の20秒間の延長されたRR間隔とテスト中の短縮されたRR間隔の比。通常、1.21以上です。境界値は1.11〜1.20です。1.10以下の係数は、心臓のリズムの副交感神経調節の違反を示します。生理学的には、テスト中、緊張の瞬間に頻脈と血管収縮が現れ、その後血圧が急上昇し、その後徐脈が発生します。
- 薬理学的試験:
- アトロピン試験。アトロピンを0.025~0.04 mg/kg、硫酸アトロピンを1.8~3 mg投与すると、完全な心臓副交感神経遮断が起こります。効果は5分以内に現れ、30分間持続します。顕著な頻脈が観察されます。迷走神経の心臓枝に損傷のある患者では、心拍数の増加は認められません。
求心性交感神経経路の状態を決定する方法
バルサルバ法: 圧力計に接続されたマウスピースに呼吸をさせ、圧力計内の圧力を 15 秒間 40 mm Hg に維持します。
この場合、胸腔内圧の上昇、動脈圧の上昇、および心拍数の変化が起こります。すべての変化は通常 1.5 ~ 2 分間続き、4 つの段階があります。段階 1 - 胸腔内圧の上昇による動脈圧の上昇。段階 2 - 静脈流入量の変化による収縮期圧と拡張期圧の低下。5 秒後、動脈圧レベルが回復し、反射性血管収縮が起こります。最初の 10 秒間は心拍数が増加します。段階 3 - 動脈圧が第 2 段階の終了レベルまで急激に低下し、大動脈の解放が起こります。この状態は、胸腔内圧が消失してから 1 ~ 2 秒間続きます。段階 4 - 収縮期圧が安静時レベルを超えて 10 秒間上昇し、脈圧が上昇します。拡張期圧は上昇するか変化しません。フェーズ 4 は、動脈圧が元のレベルに戻ると終了します。
交感神経求心性経路が損傷すると、第 2 段階の反応が遮断され、収縮期血圧と拡張期血圧の低下、心拍数の増加という形で現れます。
迷走神経が正常に機能していることが分かっている場合(臨床データおよび検査結果によると)、同時に動脈性低血圧および高血圧の間に心拍数に変化がない場合は、交感神経弓の求心性部分、つまりIX対の頭蓋神経の一部である頸動脈洞につながる経路が損傷していると考えられます。
心血管系における自律神経系の現代的な研究方法としては、非侵襲性血圧モニタリングと心拍変動の分析(PCのスペクトル分析)が挙げられます。これらの方法により、様々な機能状態における自律神経機能の統合的な定量評価が可能になり、心血管系における自律神経調節における交感神経と副交感神経の関与と影響を明らかにすることができます。
消化器系
このシステムの栄養機能を研究するために使用される方法は、自律神経系の副交感神経と交感神経の制御下にある消化管全体の運動性の研究に基づいています。
方法の説明に進む前に、胃腸障害の明らかな原因(感染症、炎症、外傷、腫瘍、癒着、肝臓および胆嚢の病理など)がすべて除外されている場合、陽性の結果は栄養病理として解釈される可能性があることを警告する必要があります。
排泄機能の研究。副交感神経流出路の状態を決定する方法
- 胃酸度。インスリンを0.01単位/kg投与し、胃酸度を測定します。健常者では、低血糖に反応して迷走神経の活動により胃酸度が上昇します。胃酸度が上昇しない場合は、胃の壁細胞につながる迷走神経枝の損傷を示します。ちなみに、これは外科的迷走神経切断術の評価における標準的な手順です。壁細胞自体が損傷しているか欠損している場合、ペンタガストリンやヒスタミンに対する胃酸度の上昇も認められません。
- 胃クロモスコープ。胃粘膜が、筋肉内投与の場合は12~15分後、静脈内投与の場合は5分後に色素(ニュートラルレッド)を分泌する能力に基づきます。分泌不全の場合、色素の分泌は著しく遅延し、無痛症の場合、全く分泌されません(交感神経優位)。
- 低血糖に対する膵ポリペプチドの反応。低血糖時には、膵臓から膵ポリペプチドが放出され、迷走神経を介して起こります。このため、インスリン投与に対する膵ポリペプチドの増加が不十分であるか、全く認められない場合は、副交感神経不全と考えられます。
胃腸の運動排泄機能の研究
記載されている方法は、節前副交感神経線維の損傷または交感神経不全を示唆しています。
方法:シンチグラフィー、X線撮影、マノメトリー。迷走神経節前副交感神経線維の損傷によって生じる食道運動の遅延、および食道神経の軸索変性に伴う運動リズムの乱れを検出することが可能です。
胃腸の造影検査、胃電図検査、超音波検査などにより、副交感神経(迷走神経)の障害による蠕動運動や排泄機能の低下、交感神経不全による運動機能亢進といった運動機能障害を検出することができます。
- バルーンキモグラフィー法。その本質は、胃内圧の変動を記録することであり、その変動は主に胃の収縮と相関します。初期の圧力レベルは胃壁の緊張を特徴づけます。空気で満たされたゴム風船は、チューブシステムとマレーカプセルを介して水圧計に接続されます。水圧計内の液体の変動はキモグラフに記録されます。キモグラムを分析する際には、胃の収縮のリズム、強度、および単位時間あたりの蠕動波の頻度を評価します。交感神経からの影響は、収縮のリズムと強度、および胃における蠕動波の伝播速度を低下させ、運動を抑制します。一方、副交感神経の影響は運動を刺激します。
- オープンカテーテル法は、バルーン・キモグラフィー法の改良法です。この場合、圧力は液体のメニスカスによって感知されます。
- 胃電図検査は、プローブを使わずに胃の運動活動を評価する方法であるという利点があります。EGG-3およびEGG-4装置を用いて、患者の体表面から胃の生体電位を記録します。フィルターシステムにより、胃の運動活動を特徴付ける狭い範囲の生体電位を特定できます。胃電図を評価する際には、単位時間あたりの周波数、リズム、振幅が考慮されます。この方法では、活性電極を前腹壁の胃の投影領域に配置しますが、これは必ずしも可能ではありません。
- EGS-4M装置を用いて遠隔点から胃の生体電位を記録する[Rebrov VG, 1975]。活性電極は右手首に、無反応電極は右足首に装着されている。
- 胃腸電気生理学(Pashelectrografiya)は、胃と腸の運動機能を同時に研究する方法です。この方法は、筋肉の収縮頻度が消化管の各部位に特異であり、主要な電気リズムの周波数と一致するという事実に基づいています[Shede H., Clifton J., 1961; Christensen J., 1971]。狭帯域フィルターを用いてこの周波数を選択し、体表面に電極を配置することで、小腸と大腸を含む消化管の対応する部位における全電位の変化の性質を追跡することが可能になります。
- 無線テレメトリー。胃内圧は、圧力センサーと無線送信機を備えたカプセルを胃に挿入して測定します。無線信号は患者の体に装着されたアンテナで受信され、変換器を介して記録装置に送信されます。得られた波形は、胃電図法と同様に解析されます。
消化器系の自律神経機能不全を診断するための、簡単で信頼性が高く有益な検査はまだ存在しません。
泌尿生殖器系
この分野では、自律神経の研究のための簡単な情報テストもまだ不足しており、使用される方法は最終効果器官の機能の研究に基づいています。
副交感神経と交感神経の流出路の状態を決定する方法
- ミクチオウロメトリーは、尿流量計という特殊な装置を使用して、副交感神経系によって制御される膀胱の排尿機能を評価する定量的な方法です。
- 膀胱内圧測定は、膀胱の運動機能と感覚機能を評価する定量的な検査法です。膀胱内圧と膀胱容量の関係に基づいて、脊髄中枢上部、節前副交感神経線維、節後神経など、損傷レベルを判定できます。
- 尿道圧プロファイル測定法は、尿道の全長にわたる圧力プロファイル(排尿時の圧力プロファイル)をグラフ化することで、尿道の状態を評価する方法です。この検査は、下部尿路の病変を除外するために使用されます。
- 膀胱尿道造影法は、内括約筋と外括約筋の協調不全を検出するための造影検査法です。
- 超音波検査は、膀胱の機能を検査する最新の非侵襲的な方法であり、排尿と充満のすべての段階を評価することができます。
- 外肛門括約筋の筋電図検査は、外肛門括約筋と同様に機能する膀胱外括約筋の協調不全を診断するために使用される方法です。
- 夜間睡眠中の勃起モニタリング - 器質性インポテンスと心因性インポテンスの鑑別診断に用いられます。副交感神経線維の器質的損傷がある場合、朝方と夜間睡眠中に勃起は消失しますが、健康な人や心因性インポテンスの場合は勃起が維持されます。
- 性器表面から誘発される皮膚交感神経電位の研究は、交感神経遠心性神経の機能を評価するために行われます。交感神経遠心性神経が損傷を受けると、反応の潜時が長くなり、振幅が減少します。
皮膚(発汗、体温調節)
交感神経流出路の状態を判定する方法
- 誘発皮膚交感神経電位の研究。この方法はGSR現象に基づいており、正中神経の電気刺激に対する皮膚生体電位を記録することから成ります。GSRの流出リンクは交感神経系であるため、結果として生じる反応の特性は、自律神経系のこの部分の分析に利用されるようになりました。4対の表面電極(20x20x1.5 mm)を手のひらと足に配置します。登録は、増幅器感度100 μV、周波数範囲1.0~20.0 Hz、分析エポック5秒の電気神経筋計を使用して実行されます。電気刺激として、持続時間0.1秒の単一の不規則な矩形パルスを使用します。電流強度は、手首レベルの正中神経の投影領域での刺激中に親指の運動反応の出現に基づいて標準として選択されます。刺激は、自発性GSRの消失後、少なくとも20秒間隔でランダムに与えられます。刺激に対する反応として、4〜6回の皮膚電気反応が平均化され、誘発皮膚交感神経電位(ESP)と呼ばれます。ESPの潜伏期とI振幅が決定されます。この方法の有用性は、全身性、内分泌性、自己免疫性疾患のさまざまな形態の多発神経障害の患者を対象とした一連の研究によって実証されました。この場合、LAの増加とESPのAMPの減少は、自律神経性発汗線維に沿った興奮伝導の違反として評価され、反応の欠如は汗線維の機能の重大な違反の結果として評価されました。ただし、ESPを分析する際には、潜伏期と振幅のパラメータが末梢神経系の障害だけでなく中枢神経系の障害によっても変化する可能性があることを常に考慮する必要があります。 VKSPデータをVNSの損傷レベルの観点から解釈する際には、臨床およびその他の準臨床研究方法(ENMG、EP、EEG、MRIなど)の結果を考慮する必要があります。この方法の利点は、非侵襲性、完全な安全性、そして結果の定量的評価です。
もう一つの有用な方法は、定量的発汗運動軸索反射試験(QSART)です。この試験では、アセチルコリンイオントフォレシスによって局所発汗を刺激します。発汗の強度は特殊な磁化率測定装置で記録され、その情報はアナログ形式でコンピューターに送信されます。この試験は、特別な断熱室で、安静時および温熱負荷(熱いお茶など)下で実施されます。研究には特別な部屋と技術的な設備が必要となるため、この方法の幅広い応用には限界があります。
近年では、発汗機能の評価に染色試験が用いられることは少なくなっています。以下に、そのいくつかを紹介します。交感神経反射弓の流出部の不全は、体の特定の部位における発汗の欠如によって判定されます。部位の特定は、マイナーのヨウ素デンプン試験またはユジェレフスキーのクロムコバルト試験を用いて発汗を観察することで行います。発汗は様々な方法で達成されます。
-
- アスピリン試験:1gのアセチルサリチル酸を一杯の熱いお茶と一緒に摂取すると、脳器官を通して拡散した発汗を引き起こします。皮質病変の場合、単麻痺型の発汗がより頻繁に発生し、発汗が消失または減少します。
- 被験者を乾燥空気ボックス、加温チャンバー、または両肢を温水(43℃)に浸漬することで加温すると、脊髄側角の細胞を介して脊髄発汗反射が誘発されます。脊髄の分節部に損傷がある場合、加温処置やアスピリンテストによって、対応する部位における発汗の消失または減少が明らかになります。
- ピロカルピン試験:1%ピロカルピン溶液1mLを皮下注射し、終末汗腺に作用させると、通常、体の特定の部位で発汗が起こります。この試験で発汗が見られない場合、または発汗腺が欠損しているか損傷している場合に発汗が減少することが観察されます。
- 軸索反射試験:ファラデー電流刺激、アセチルコリン(5~10mg)の皮内注射、またはアセチルコリンの電気泳動により、通常、5分後に局所的な立毛と発汗が起こります。立毛がない場合、発汗が減少または消失する場合は、交感神経節または節後ニューロンの損傷が示唆されます。
- サーモバイザーを使用した表面皮膚温度の研究:得られたサーモグラムの本質である赤外線放射強度を記録します。等温線効果を使用して、赤外線放射値を定量化します。温度値は度で記録されます。サーモグラムの解釈は、熱非対称性の存在と、皮膚の遠位部と近位部の温度差を反映する縦方向末端勾配の値に基づいています。サーモグラムと皮膚温度強度の研究により、上半身が下半身よりも暖かく、左右の四肢が対称的なイメージを特徴とし、四肢の近位部が遠位部よりも暖かく、その差はわずかで緩やかであることが示されました。脳自律神経障害の患者では、サーモグラフィー指標による皮膚温度の分布は、次のタイプで表されます。
- 前腕の下3分の1のレベルでの両側の「熱切断」、手足の低体温(2〜4℃の急激な体温低下を伴う)。
- 手足の高体温(視床下部症候群の患者によく見られる)
- さまざまな種類の非対称性:
- 片手の「熱切断」
- 手足の非対称「熱切断」。
自律神経系の分節部分が影響を受けると、主にさまざまなタイプの非対称性が観察されます。
瞳
交感神経系と副交感神経系は、瞳孔を散大・収縮させる筋肉を支配することが知られています。神経薬理学的研究により、虹彩の筋肉を支配する自律神経の節前損傷と節後損傷を区別することが可能になりました。この分析により、瞳孔を散大させる筋肉の交感神経線維の損傷による眼瞼下垂および縮瞳の発生を、この筋肉につながる交感神経経路のより近位の損傷に基づくホルネル症候群、そして瞳孔を収縮させる筋肉を支配する節後副交感神経線維の損傷と現在関連付けられているアディー症候群(緊張性瞳孔散大)、そして節前線維の損傷によって生じる散瞳と区別することが可能になります。
神経薬理学的分析法は、交感神経節後線維および副交感神経節後線維の脱神経過敏症という現象に基づいています。縮瞳または眼瞼下垂時に縮瞳した瞳孔に脱神経過敏症がみられる場合、病変は交感神経節前線維ではなく、頭蓋底または内頸動脈に沿った節後線維に局在することが示されています。散瞳時に散瞳した瞳孔に脱神経過敏症がみられる場合、脳幹、海綿静脈洞、または頸髄の節前線維の損傷も考えにくいです。これは、毛様体神経節または眼球外層における交感神経節後線維の損傷に典型的に見られます。
瞳孔を検査し、神経薬理学的検査を行う際には、いくつかのルールがあります。
- 2 分間隔で各目に薬剤 1 滴を点眼します。
- この検査は欠陥を検出するためのものであるため、10 分間隔で 3 回、つまり各目に 6 滴ずつ点眼する必要がある場合があります。
- 片側の瞳孔の大きさに異常がある患者では、両方の瞳孔を検査する必要があります。
- 散瞳側の瞳孔が収縮し、もう一方の瞳孔が反応しない場合、脱神経過敏症が検出されたとみなされます。反応がない場合、両眼を検査した上で薬剤の濃度を高めることができます。散瞳側の瞳孔が強く収縮しないにもかかわらず、正常な瞳孔が収縮し始める場合にのみ、散瞳側の脱神経過敏症を除外できます。
両眼の瞳孔病変の場合は比較が不可能であり、片方の眼のみを検査し、もう片方の眼は対照として用いる必要があります。
縮瞳における交感神経脱神経過敏症検査
- 0.1%アドレナリン投与:正常な瞳孔はアドレナリン点眼に反応して散瞳しません。脱神経性過敏症では、アドレナリンは散瞳を引き起こします。過敏症は節後交感神経経路の損傷によって最大となり、瞳孔は2mm以上散瞳します。アドレナリンは節前交感神経線維(特に「最初のニューロン」)の損傷では瞳孔径に大きな変化を引き起こさないため、完全型ホルネル症候群ではこの検査は陰性となります。
- 4%コカイン溶液を用いた検査:コカインは単独で使用されることは稀です。これは、交感神経損傷部位を特定できないためです。多くの場合、アドレナリン検査と組み合わせて使用されます。併用検査の方法:4%コカイン溶液を2滴投与し、必要に応じて3回繰り返します。縮瞳を伴う明瞭な散瞳は、交感神経節前線維の損傷を示唆します。反応が見られない場合は、30分後に0.1%アドレナリン溶液を点眼します。瞳孔がわずかに拡張する場合は、交感神経節前線維(第2のニューロン)の損傷が疑われます。明瞭な瞳孔拡張は、交感神経節後線維の損傷の診断的兆候です。
散瞳における副交感神経脱神経過敏症試験
2.5%メコリル点眼液を使用します。各眼に1滴ずつ点眼し、5分後に点眼を繰り返します。緊張性散瞳した瞳孔はメコリルに反応し、顕著な縮瞳が見られます。健常瞳孔には反応が見られません。この検査はアディ症候群の診断において有用です。
内眼筋麻痺:原因の特定には薬理学的検査は必要ありませんが、神経学的な局所分析が必要です。
薬理学的試験のほかにも、他の試験があります。
- 瞳孔周期時間。細隙灯を用いて、細い帯状の光を瞳孔の縁に照射します。この反応として、瞳孔のリズミカルな収縮と縮瞳が観察されます。健康な人におけるこのような周期(縮瞳-拡張)の時間は946±120ミリ秒です。瞳孔周期時間の延長は、副交感神経機能不全を示唆します。
- フラッシュを用いたポラロイド写真は、暗闇での瞳孔の大きさを測定する方法の一つです。暗順応した瞳孔の大きさを虹彩の外径と比較して測定することで、交感神経支配の状態を評価することができます。散瞳が不十分な場合は、交感神経機能不全が示唆されます。この方法は、交感神経機能のわずかな変化にも敏感です。
- 赤外線テレビ瞳孔測定法は、安静時、光に反応した時、暗闇での瞳孔の正確な寸法を測定できる定量的な方法であり、瞳孔の自律神経支配を評価するための広範な情報を提供します。
- 虹彩異色症:交感神経系はメラニンの生成に影響を与え、虹彩の色を決定します。片方の虹彩の色素沈着の異常は、幼児期における交感神経線維の損傷を示唆します。成人における色素脱失は非常にまれです。成人における色素脱失の原因は、局所的な疾患または先天性の単独異常である可能性があります。ホルネル症候群(通常は先天性)では、交感神経支配の障害による他の症状と併発して色素脱失が観察されることがあります。
何を調べる必要がありますか?


