ヒト免疫不全ウイルス(HIV)
最後に見直したもの: 04.07.2025
後天性免疫不全症候群は、1981年にアメリカ合衆国で特定の疾患として特定されました。当時、健康な人には病原性がない、あるいは病原性が弱い微生物によって、多くの若者が重篤な疾患を発症しました。患者の免疫状態を調べたところ、リンパ球全体、特にヘルパーT細胞の数が急激に減少していることが明らかになりました。この病態はエイズ(後天性免疫不全症候群)と呼ばれました。感染経路(性行為、血液およびその製剤経由)から、この疾患の感染性は明らかでした。
エイズの原因となるウイルスは、1983年にフランス人のL.モンタニエによって独立して発見されました。モンタニエは、リンパ節腫脹の患者からこのウイルスを発見したため、LAVリンパ節腫脹関連ウイルスと名付けました。また、アメリカ人のR.ギャロは、このウイルスをHTLV-III(ヒトTリンパ球向性ウイルスIII)と名付けました。ギャロは、それ以前にリンパ球向性ウイルスIとIIを発見していました。
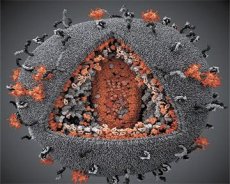
LAVウイルスとHTLV-IIIウイルスの特性を比較した結果、両者の同一性が明らかになったため、混乱を避けるため、1986年にこのウイルスはHIV(ヒト免疫不全ウイルス、略してHIV)と命名されました。HIVは球形で、直径は110nmです。ウイルスエンベロープは多面体で、12個の五角形と20個の六角形で構成されています。各六角形の中心と角には、糖化タンパク質gpl20の分子があります(120という数字は、タンパク質の分子量をキロダルトンで表したものです)。合計72個のgpl20分子が、独特のスパイクの形でビリオンの表面に位置しており、それぞれが膜内タンパク質gp41と関連しています。これらのタンパク質は、二重の脂質層とともに、ビリオンのスーパーカプシド(膜)を形成します。
Gpl20タンパク質とgp41タンパク質は、細胞性プロテアーゼによってEnv前駆体タンパク質が切断されることによって形成される。gp41タンパク質は、その細胞質ドメインがエンベロープ直下に位置するマトリックスタンパク質p17MAに結合し、スパイク状の「茎」を形成する。p17分子は、ビリオンの成熟過程において相互作用し、エンベロープの下部に正20面体を形成する。
ウイルス粒子の中心部では、p24タンパク質が円錐状のカプシドを形成します。カプシドの狭くなった部分は、rbタンパク質を介してウイルス粒子膜に結合しています。カプシド内には、2つの同一のウイルスゲノムRNA分子が存在します。これらは5'末端でヌクレオカプシドタンパク質p7NCに結合しています。このタンパク質は、システインとヒスチジンに富み、亜鉛原子を含む2つのアミノ酸残基(モチーフ)を持つという点で興味深いものです。これらのモチーフは、形成中のウイルス粒子に組み込むためにゲノムRNA分子を捕捉することから「ジンクフィンガー」と呼ばれています。カプシドには3つの酵素も含まれています。リバーターゼ(RT)、またはポリメラーゼ複合体は、逆転写酵素、RNase H、およびDNA依存性DNAポリメラーゼを含みます。リバーターゼはp66/p51ヘテロ二量体として存在します。プロテアーゼ(PR)であるp10は、ウイルス粒子の成熟プロセスを開始し、実行します。インテグラーゼ(IN) - p31、またはエンドヌクレアーゼは、プロウイルスDNAが宿主細胞のゲノムに組み込まれることを確実にします。カプシドにはプライマーRNA(tRNAl-3)分子も含まれています。
細胞内のRNAゲノムは、逆転写酵素の助けを借りて、9283ヌクレオチド対からなるDNAゲノム(DNAプロウイルス)に変換されます。DNAゲノムの左右は、いわゆる長末端反復配列(LTR)によって区切られています。左側はS'-LTR、右側は3'-LTRです。LTRはそれぞれ638ヌクレオチド対で構成されています。
HIVゲノムは9つの遺伝子から構成されており、その一部は末端で重複し(複数の読み枠を持つ)、エクソニントロン構造を有しています。これらの遺伝子は、9つの構造タンパク質と6つの調節タンパク質の合成を制御しています。
ウイルスゲノムにとって LTR が重要なのは、ウイルスゲノムの機能を制御する以下の調節要素が含まれているからです。
- 転写シグナル(プロモーター領域)
- ポリA付加シグナル;
- キャッピング信号;
- 統合信号;
- 正の調節シグナル(TATタンパク質の場合はTAR)
- 負の調節要素(NEFタンパク質の場合はNRE)
- 3' 末端にマイナス鎖 DNA 合成用のプライマー RNA (tRNA™3) を結合する部位。LTR の 5' 末端に、プラス鎖 DNA 合成用のプライマーとして機能するシグナル。
さらに、LTRには、mRNAスプライシングの制御、vRNA分子のカプシドへのパッケージング(Psiエレメント)に関与するエレメントが含まれています。最後に、ゲノム転写中に、REVタンパク質の長鎖mRNAに2つのシグナルが形成され、タンパク質合成を切り替えます。CARは調節タンパク質、CRSは構造タンパク質です。REVタンパク質がCARに結合すると構造タンパク質が合成されますが、CARが結合しない場合は調節タンパク質のみが合成されます。
以下の調節遺伝子とそのタンパク質は、ウイルスゲノムの機能を制御する上で特に重要な役割を果たします。
- ウイルス複製の正の制御を実行し、TAR 調節領域を介して作用する TAT タンパク質。
- NRE 領域を介して複製の負の制御を行う NEV および VPU タンパク質。
- 正負の制御を行うREVタンパク質。REVタンパク質はgag、pol、env遺伝子の働きを制御し、スプライシングの負の制御を行います。
したがって、HIV 複製は、正、負、正負の 3 つの制御下にあります。
VIFタンパク質は、新たに合成されたウイルスの感染性を決定します。これはp24カプシドタンパク質と結合しており、ウイルス粒子中に60分子存在します。NEFタンパク質は、ウイルス粒子中に少数の分子(5~10分子)として存在し、エンベロープと結合している可能性があります。
VPRタンパク質は、G2期で細胞周期を阻害し、前統合複合体の細胞核への輸送に関与し、一部のウイルス遺伝子および細胞遺伝子を活性化し、単球およびマクロファージにおけるウイルス複製効率を高めます。ウイルス粒子におけるVPR、TAT、REV、およびVPUタンパク質の位置は未だ解明されていません。
ウイルス粒子膜には、ウイルス粒子自身のタンパク質に加えて、宿主細胞のタンパク質も含まれる場合があります。VPUタンパク質とVPRタンパク質は、ウイルスの増殖の制御に関与しています。
ヒト免疫不全ウイルス(HIV)の抗原変異体
ヒト免疫不全ウイルス(HIV)は非常に変異性が高い。同じ患者の体内からでも、抗原特性が大きく異なるウイルス株が分離されることがある。このような変異は、CD4+細胞の集中的な破壊とHIV感染に対する強力な抗体反応によって促進される。西アフリカの患者から、生物学的にはHIV-1に近いが免疫学的には異なる、新しい形態のHIVであるHIV-2が分離されている。これらのウイルスのゲノムの一次構造の相同性は42%である。DNAプロウイルスHIV-2は9671 bp、そのLTRは854 bpである。その後、HIV-2は世界の他の地域でも分離されている。HIV-1とHIV-2の間には交差免疫はない。HIV-1にはO(Outlier)とM(Major)という2つの大きな形態が知られており、後者は10のサブタイプ(AJ)に分けられる。ロシアでは8つのサブタイプ(AH)が流行している。
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
HIVと細胞の相互作用のメカニズム
体内に侵入したウイルスは、まずウイルス特異的なCD4受容体を持つ細胞を攻撃します。この受容体はT細胞(ヘルパーT細胞)に多く、マクロファージと単球には少量存在し、特にT細胞(ヘルパーT細胞)はウイルスに対して感受性が高いです。
ヒト免疫不全ウイルス(HIV)は、gpl20タンパク質を用いてCD4受容体を認識します。HIVと細胞との相互作用は、受容体を介した吸着→被覆小胞→被覆小胞→リソソームという経路で進行します。この経路では、ウイルス粒子膜がリソソーム膜と融合し、スーパーカプシドから解放されたヌクレオカプシドが細胞質へ移行します。核へ向かう途中でヌクレオカプシドは破壊され、ゲノムRNAとそれを構成する核成分が放出されます。その後、逆転写酵素がウイルス粒子RNA上にマイナス鎖DNAを合成し、RNase Hがウイルス粒子RNAを破壊します。そして、ウイルスDNAポリメラーゼがプラス鎖DNAを合成します。DNAプロウイルスの末端には5'-LTRと3'-LTRが形成されます。 DNAプロウイルスは、不活性状態で核内に一定期間留まることがありますが、遅かれ早かれ、インテグラーゼの助けを借りて標的細胞の染色体に組み込まれます。標的細胞内では、Tリンパ球が微生物抗原または他の免疫担当細胞によって活性化されるまで、プロウイルスは不活性状態を維持します。細胞DNA転写の活性化は、特殊な核因子(NF-κB)によって制御されます。NF-κBはDNA結合タンパク質であり、Tリンパ球および単球の活性化および増殖中に大量に産生されます。このタンパク質は、細胞DNAの特定の配列およびDNAプロウイルスの類似のLTR配列に結合し、細胞DNAとDNAプロウイルスの両方の転写を誘導します。DNAプロウイルスの転写を誘導することにより、ウイルスは不活性状態から活性状態へ、ひいては持続感染から増殖感染へと移行します。プロウイルスは非常に長期間、不活性状態を維持できます。ウイルスの活性化は、細胞との相互作用における重要な瞬間です。
ウイルスが細胞に侵入した瞬間から、HIV感染期間(ウイルスキャリア状態)が始まります。この期間は10年以上続くこともあります。そして、ウイルスが活性化した瞬間から、エイズという病気が始まります。ウイルスは、制御遺伝子とその産物の助けを借りて、活発に増殖し始めます。TATタンパク質は、ウイルスの増殖速度を1000倍に高めることができます。ウイルスの転写は複雑で、全長mRNAとサブゲノムmRNAの形成、mRNAのスプライシング、そして構造タンパク質と制御タンパク質の合成が行われます。
構造タンパク質の合成は次のように起こる。まず、Pr55Gag 前駆体ポリタンパク質(分子量 55 kDa のタンパク質)が合成される。これは、マトリックス(MA)、カプシド(CA)、ヌクレオカプシド(NC)、および rb ドメインの 4 つの主要ドメインから構成され、ウイルスのプロテアーゼによる Pr55Gag の切断(別の前駆体タンパク質 Gag-Pol からも自己切断される)の結果として、それぞれ構造タンパク質 p17、p24、p7、および rb が形成される。Pr55Gag ポリタンパク質の形成は、ウイルス粒子形成の主な条件である。このタンパク質が、ビリオン形態形成プログラムを決定する。このプログラムには、Gag ポリタンパク質の細胞膜への輸送、細胞膜との相互作用、およびウイルス粒子の形成と出芽中のタンパク質間相互作用という段階が順に含まれる。Pr55Gag は遊離ポリリボソーム上で合成される。タンパク質分子は膜へ輸送され、そこで疎水性領域によって固定されます。CAドメインは、Gagタンパク質の本来の立体構造を形成する上で主要な役割を果たします。NCドメインは、「ジンクフィンガー」の助けを借りて、2分子のゲノムRNAが形成中のウイルス粒子の構成成分に含まれるようにします。ポリタンパク質分子は、まずマトリックスドメインの相互作用によって二量体を形成します。次に、二量体はCAドメインとNCドメインの相互作用によって6量体(6ユニット)の複合体を形成します。最終的に、六量体は側面で結合し、未熟な球状のウイルス粒子を形成します。このウイルス粒子内には、NCドメインによって捕捉されたゲノムウイルスRNAが含まれます。
もうひとつの前駆体タンパク質である Prl60Gag-Pol(分子量 160 kDa のタンパク質)は、gag 遺伝子の 3' 末端の rb タンパク質をコードする領域のすぐ上流に位置する領域を翻訳中に、リボソームによるフレームシフトの結果として合成されます。この Gag-Pol ポリタンパク質には、不完全な Gag タンパク質配列(1~423 アミノ酸)と、PR、RT、および IN ドメインを含む Pol 配列が含まれています。Gag-Pol ポリタンパク質分子も遊離ポリリボソーム上で合成され、細胞膜へ輸送されます。Prl60Gagpol ポリタンパク質には、Gag ポリタンパク質に固有の分子間相互作用部位と膜結合部位がすべて含まれています。そのため、Gag-Pol ポリタンパク質分子は膜と融合し、Gag 分子とともに形成中のビリオンに取り込まれ、活性プロテアーゼの出現とビリオン成熟プロセスの開始を引き起こします。 HIV-1プロテアーゼは二量体でのみ高い活性を示すため、Prl60Gag-Polからの自己切除には、これらの分子の二量体化が必要となる。ウイルス粒子の成熟は、放出された活性プロテアーゼがprl60Gag-PolとGag55を認識部位で切断することで実現される。p17、p24、p7、p6、リバーターゼ、インテグラーゼといったタンパク質が形成され、それらがウイルス構造に結合して形成される。
Envタンパク質は小胞体膜に結合したリボソーム上で合成され、その後グリコシル化され、細胞内プロテアーゼによってgp120とgp41に切断され、細胞表面へ輸送されます。この場合、gp41は膜を透過し、膜内表面に結合するGagタンパク質分子のマトリックスドメインに結合します。この結合は成熟ウイルス粒子においても維持されます。
このように、ウイルス粒子の組み立ては、宿主細胞の細胞膜上での前駆体タンパク質と関連するRNA分子の凝集、未熟なウイルス粒子の形成、そして細胞表面からの出芽による放出から構成されます。出芽中、ウイルス粒子はgp41分子とgp120分子が埋め込まれた細胞膜で自身を囲みます。出芽中、あるいは場合によっては放出後に、ウイルス粒子の成熟が起こります。これはウイルスプロテアーゼの助けを借りて行われ、前駆体タンパク質Pr55GagとPrl60Gag-Polがタンパク質分解によって成熟ウイルスのタンパク質に切断され、それらが特定の構造複合体に結合します。ウイルスの形態形成プロセスにおいて主導的な役割を果たすのは、未熟なウイルス粒子を組織化し、組み立てる前駆体ポリタンパク質Pr55Gagです。その成熟プロセスは、特定のウイルスプロテアーゼによって完了します。
免疫不全の原因
HIV感染における免疫不全の主な原因の一つは、T細胞ヘルパーの大量死です。これは、以下の事象の結果として起こります。第一に、ウイルスに感染したT細胞ヘルパーはアポトーシスによって死滅します。エイズ患者においては、ウイルスの複製、アポトーシス、そしてT細胞ヘルパー数の減少が相互に関連していると考えられています。第二に、T細胞キラーは、ウイルスに感染したT細胞、あるいはgpl20分子を吸着したT細胞、そしてウイルス感染および非感染のT細胞ヘルパーを認識して破壊します。これらのT細胞は数十個の細胞からなるシンシチウム(合胞体)を形成しますが、その一部は細胞内でウイルスの増殖によって死滅します。多数のヘルパーT細胞の破壊の結果、Bリンパ球におけるインターロイキン-2に対する膜受容体の発現が低下し、様々なインターロイキン(Bリンパ球の成長因子および分化因子 - IL-4、IL-5、IL-6など)の合成が阻害され、Tキラーシステムの機能が阻害されます。補体系およびマクロファージ系の活動は抑制されます。ウイルスに感染したマクロファージおよび単球は長期間死滅しませんが、ウイルスを体内から排除することはできません。最終的に、gpl20は体内の一部の上皮細胞の受容体(HIVの移植伝播を媒介する栄養芽層受容体を含む)と構造的および抗原的に類似しているため、広範囲の作用スペクトルを持つ抗受容体抗体が合成されます。このような抗体は、様々な細胞受容体を阻害し、自己免疫疾患によって疾患の経過を複雑化させる可能性があります。 HIV感染の結果、免疫システムの主要な機能がすべて失われます。患者は様々な微生物に対して無防備になり、日和見感染症や腫瘍の発生につながります。HIV感染患者は、少なくとも3種類の癌を発症するリスクが高まります。カポジ肉腫、癌(皮膚癌を含む)、Bリンパ球の悪性転換によって発生するB細胞リンパ腫です。しかし、HIVはリンパ球親和性だけでなく、神経親和性も持っています。HIVは、受容体を介したエンドサイトーシスと、アストロサイトによるウイルス感染リンパ芽球の貪食の両方によって、中枢神経系(アストロサイト)の細胞に侵入します。ウイルスがアストロサイトと相互作用すると、シンプラストも形成され、これが細胞間チャネルを介した病原体の拡散を促進します。ウイルスはマクロファージと単球に長期間生存するため、体内でウイルスの貯蔵庫および分配器として機能し、あらゆる組織に侵入することができます。感染したマクロファージは、HIVの中枢神経系への侵入と損傷において主要な役割を果たします。患者の10%では、中枢神経系の損傷を伴う一次臨床症候群が認知症として現れます。したがって、HIV感染者は、日和見感染症、腫瘍性疾患および中枢神経系の損傷。
HIV感染の疫学
HIV感染源は、病人またはウイルスキャリアのいずれかであるヒトのみです。ヒト免疫不全ウイルス(HIV)は、血液、精子、子宮頸管粘液、そして授乳中の母親の場合は母乳に含まれています。感染は性行為、血液およびその製剤、そして出産前、出産中、出産後の母子間で起こります。食品、飲料、虫刺されを介してウイルスに感染した例は知られていません。
薬物中毒はエイズの蔓延に寄与しています。HIVの感染率は年々増加しています。WHOによると、1980年から2000年の間に5,800万人がHIVに感染しました。2000年だけでも、世界中で530万人が感染し、300万人がエイズで亡くなりました。2004年1月1日現在、ロシアでは26万4千人のHIV感染者が登録されています。HIV感染者の半数は、感染から11~12年以内に死亡しています。2004年初頭には、ロシア国民10万人あたり約180人が「HIV感染」と診断されていました。この罹患率では、2012年までにロシアのHIV感染者総数は250万人から300万人に達すると予測されています。HIV感染との闘いが困難な理由はいくつかあります。第一に、効果的な治療法や予防法が存在しないことです。第二に、HIV感染の潜伏期間は10年を超える場合があります。その期間は、Tリンパ球とその染色体に含まれるDNAプロウイルスの活性化時期に依存します。ウイルスに感染したすべての人がエイズを発症するのか、あるいは発症することなくウイルスを長期保有する可能性があるのか(可能性は低いと思われます)は、依然として不明です。最後に、ヒト免疫不全ウイルスには複数の種類(HIV-1、HIV-2)があり、それらの抗原性の違いが交差免疫の形成を妨げています。サル免疫不全ウイルス(SIV)の発見は、HIVの起源に関する疑問に光を当てました。SIVはゲノム構成においてHIVに類似していますが、ヌクレオチド配列は大きく異なります。HIV-2は血清学的特性においてHIV-1とSIVの中間に位置し、ヌクレオチド配列はSIVに近いです。この点について、VM・ジダーノフは、HIV-1、HIV-2、SIVウイルスは共通の祖先に由来すると示唆しました。 R. ギャロ氏によると、SIV の 1 つが何らかの形で人体に入り込み、一連の突然変異を起こして、HIV-1、HIV-2、およびその他の形態が出現した可能性があるとのことです。
HIV感染の症状
ヒト免疫不全ウイルスには、疾患の病因を大きく左右するいくつかの特徴があります。ウイルスの増殖速度は非常に高く、これは制御因子によって決定されます(活性段階では5分間に最大5,000個のウイルス粒子が合成されます)。融合タンパク質(gp41)の存在により、ウイルスは感染T細胞と非感染T細胞の融合による広範な合胞体構造の形成を誘導し、その結果、これらのT細胞は大量死に至ります。大量に形成されたgpl20タンパク質分子は血中を自由に循環し、非感染T細胞の受容体に結合します。その結果、キラーT細胞によっても認識・破壊されます。ウイルスは細胞間チャネルを介して細胞から細胞へと拡散しますが、その場合、抗体のアクセスは困難になります。
HIV感染の臨床基準
成人の場合、HIV感染は、少なくとも2つの重篤な症状と少なくとも1つの軽微な症状を併発し、かつ他の既知の免疫不全の原因(がん、先天性免疫不全、重度の飢餓など)がない場合に診断されます。重篤な症状には以下のものがあります。
- 10%以上の体重減少
- 断続的または持続的な長期の発熱状態。
- 慢性の下痢。
軽症:持続性咳嗽、全身性皮膚炎、再発性帯状疱疹、口腔カンジダ症および咽頭カンジダ症、慢性単純ヘルペス、全身性リンパ節腫脹。カポジ肉腫、クリプトコッカス髄膜炎、ニューモシスチス肺炎のいずれかが認められる場合のみ、AIDSと診断されます。本疾患の臨床像は、併発する日和見感染の影響を受けます。
ヒト免疫不全ウイルス(HIV)の培養方法
HIV-1およびHIV-2は、白血病性TCV4リンパ球から得られたTCV4リンパ球クローンH9のみで培養可能です。HIV-1が良好に増殖するアストロサイト細胞の単層培養も、この目的に使用できます。動物の中では、チンパンジーがHIV-1に感受性があります。
ウイルスの外部環境に対する耐性は低い。日光や紫外線の影響で死滅し、80℃で30分以内に分解される。一般的な消毒剤を用いた場合、20~30分以内に分解される。ウイルスを含む物質を消毒するには、最も耐性の高い微生物に対して有効な抗酸菌性消毒剤を使用する必要がある。
HIV感染の臨床検査診断
ウイルス保有およびHIV感染の診断には、主に酵素免疫測定法が用いられます。しかし、gpl20は、粘膜上皮細胞を介して免疫グロブリンを輸送する受容体を含む、一部のヒト細胞の受容体と構造的および抗原的に類似しているため、gpl20に対する抗体に関連する抗体が体内に出現する可能性があります。この場合、ELISAで偽陽性反応が出る可能性があります。そのため、陽性反応を示した被験者の血清はすべて、免疫ブロット法(ウェスタンブロッティング)による追加分析が行われます。この方法は、電気泳動分離後に抗体を同定し、標識抗種抗体を用いて検査を行うものです。ウイルス学的方法は、ウイルス培養の複雑さからほとんど使用されません。診断検査システムに必要なウイルス抗原を得るために、H9リンパ球クローンが使用されます。CPR法は、ウイルス血症の早期段階でウイルスを検出することを可能にします。
HIV感染症の治療
逆転写酵素(リバーターゼ)またはウイルスプロテアーゼの活性を効果的に抑制する薬剤を発見または合成する必要があります。これらの薬剤は、DNAプロウイルスの形成を阻害し、(あるいは)細胞内でのウイルスの増殖を阻害します。HIV感染患者の治療における現代の戦略は、ウイルスプロテアーゼを阻害する薬剤(1種類)とリバーターゼを阻害する薬剤(2種類)の併用療法、つまり併用療法(トリプル療法)の原則に基づいています。ロシアでは、HIV感染患者の治療において、ホスファジドとクリキシバンという2種類の国内薬剤の併用が推奨されています。これらの薬剤は、特にアジドチミジンの活性を低下させることで、HIVの増殖を初期段階と後期段階に特異的に抑制します。
特異的予防法の問題は、抗体の顕著な産生を伴わずに、ウイルス特異的な細胞傷害性リンパ球に基づく効果的な細胞性免疫の形成を確実にするワクチンを開発する必要があることです。このような免疫はTh1ヘルパーによって提供されます。ウイルス中和抗体を含む抗体は、HIV感染の抑制に効果がないだけでなく、高いレベルでは細胞性免疫を抑制する可能性があります。したがって、抗HIVワクチンは、まず第一に、a) 絶対的に安全であること、b) T細胞傷害性リンパ球の活性を刺激することという2つの主要な要件を満たす必要があります。不活化ウイルスや高い防御特性を持つ個々の抗原から得られる様々なワクチン変異体の有効性が研究されています。このような抗原は、ウイルス粒子自体から単離することも、化学的に合成することもできます。遺伝子工学的手法に基づいて作製されたワクチンが提案されています。これは、強力な免疫原性を持つ抗原の合成を担うHIV遺伝子を含む組換えワクシニアウイルスです。 HIV感染の潜伏期間の長さと病原体の多様性の高さから、これらのワクチンの有効性については相当の時間を要します。HIVに対する非常に効果的なワクチンの開発は、喫緊の根本的な課題です。


