ドーパミン
最後に見直したもの: 03.07.2025
適応症 ドーパミン
ドパミンの使用適応症には、慢性心不全、外傷、腎不全、さらには開心術後の血圧維持、心筋梗塞や敗血症によるショックなどがある。低用量ドパミンの投与は、低血圧、心拍出量低下、臓器不全(多くの場合、尿量低下によって示される)の治療にも有効である可能性がある。ホルニエヴィッツの実験によりパーキンソン病患者の尾状核におけるドパミンの減少が示された後、ドパミンは中枢神経系(CNS)において臨床的に重要な位置を占めるようになった。さらに、そのアミノ酸前駆体であるL-ドパ(L-ジヒドロキシフェニルアラニン)の静脈内投与により、パーキンソン病の症状が軽減される。[ 3 ] 血液脳関門により、DAが全身循環からCNSに入ることができないため、DAはパーキンソン病などの中枢神経疾患には効果がない。しかし、L-DOPAは血液脳関門を通過し、経口錠を含む全身投与が可能です。治療的ドーパミン補充療法は運動症状の緩和に効果的ですが、運動機能の副作用や依存症関連の行動障害(例:衝動制御障害)を引き起こす可能性があります[ 4 ]、[ 5 ]、[ 6 ]。
リリースフォーム
ドーパミンは、輸液用の濃縮液としてアンプルで入手できます。
薬力学
ドーパミンの生合成は、ノルエピネフリン(NE)と同じ酵素配列に従います。実際、DAはNE合成の前駆体です(図を参照)。[ 7 ]、[ 8 ] DA合成の最初のステップは律速段階であり、チロシン水酸化酵素(TH)によるL-チロシンからL-DOPAへの変換が含まれます。[ 9 ]、[ 10 ] この変換には酸素、鉄補因子、テトラヒドロビオプテリン(BH4またはTHB)が必要であり、芳香環にヒドロキシル基が付加されてL-DOPAが形成されます。この分子はその後、芳香族L-アミノ酸脱炭酸酵素によってカルボキシル基が除去され、DAに変換されます。合成されたDAは、小胞モノアミントランスポーター2(VMAT2)を介してシナプス小胞に輸送され、シナプス終末に達します。[ 11 ]、[ 12 ]
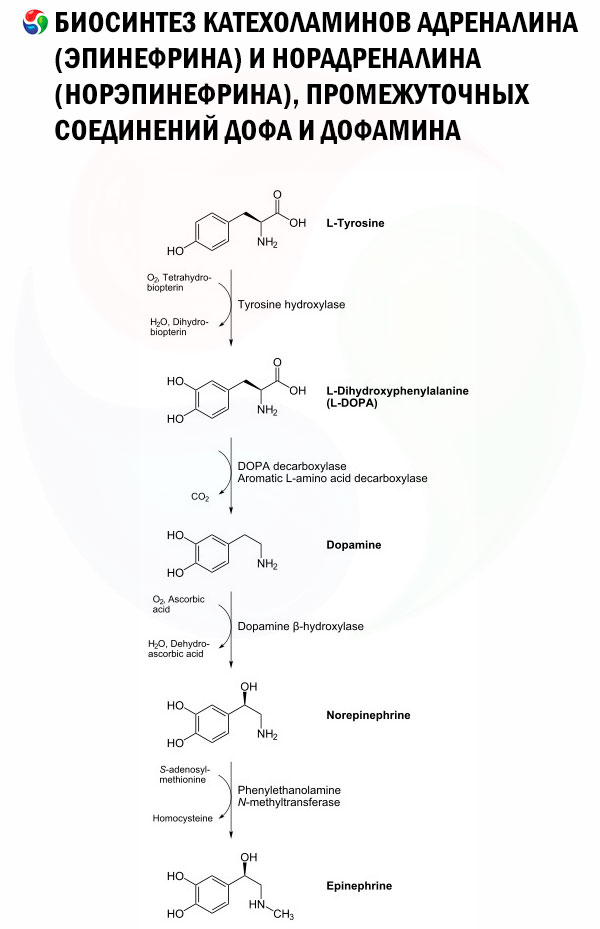
L-チロシンを大量に定期的に摂取すると、L-DOPAと同様に血液脳関門を容易に通過します。[ 13 ] しかし、DAは血液脳関門を通過できないため、その有用性は空間的に限定されます。一方、L-チロシン濃度が低い場合、L-フェニルアラニンはフェニルアラニン水酸化酵素によってL-チロシンに変換されます。
ドーパミンがシナプス間隙に放出されると、シナプス前終末およびシナプス後終末の様々な受容体と相互作用し、標的ニューロンの興奮または抑制を引き起こします。ドーパミン受容体には2つのファミリーがあり、それぞれが異なる細胞内シグナル伝達経路に作用します。[ 14 ] ドーパミン受容体のファミリーであるD1とD2は、どちらも定義上Gタンパク質共役受容体ですが、D1受容体クラスはニューロンの脱分極を引き起こすのに対し、D2受容体はニューロンの興奮を抑制します。[ 15 ]
シナプス間隙に入ったDAは、DAトランスポーター(DAT)を介してシナプス前ニューロンに輸送され、再パッケージングされるか、細胞外スペースに留まってグリア細胞に取り込まれるか、細胞膜によって代謝されます。DAは、ニューロン外でカテコール-O-メチルトランスフェラーゼ(COMT)によって3-メトキシチラミン(3-MT)に代謝される一方で、モノアミン酸化酵素B(MAO-B)は3-MTをホモバニリン酸(HVA)に急速に代謝します。[ 16 ] さらに、DAは細胞質内で代謝され、MAO-Aとアルデヒド脱水素酵素(ALDH)の二重作用によって、DAはフェノール酸の3,4-ジヒドロキシフェニル酢酸(DOPAC)に変換されます。[ 17 ]
この複雑な配列を考慮すると、ドーパミンの調節は、ニューロン全体、その投射、あるいは神経系の神経回路など、様々なレベルで起こり得る。さらに、ドーパミン合成(転写、翻訳、翻訳後制御)、シナプトソームパッケージング(VMAT制御、シナプスへの小胞輸送)、ドーパミン放出(神経細胞の脱分極、カルシウムシグナル伝達、小胞融合)、そして再取り込みと代謝を通して、対応する酵素の制御と基質に対するそれらの空間的局在を通して、ドーパミン調節が起こり得る。[ 18 ]
前述のように、ドーパミンの全身作用は、様々な受容体(D1、D2、D3、D4、D5)とαおよびβアドレナリン受容体に依存します。これらのG共役受容体は、ドーパミンがアデニル酸シクラーゼ活性を調節できるという従来の生化学的機能に基づき、一般的にD1またはD2に分類されます。[ 19 ] しかし、分子構造、生化学的特性、および薬理学的機能に基づき、ドーパミン受容体はさらにD1クラス(D1およびD5)またはD2クラス(D2、D3、D4)に分類されます。[ 20 ],[ 21 ]
平滑筋、近位尿細管、および皮質集合管上のD1受容体の活性化は利尿作用を増強する。[ 22 ] D2受容体は、腎神経、糸球体、および副腎皮質のシナプス前層に位置する。これらの神経の活性化は、腎臓からのナトリウムおよび水の排泄を減少させる。[ 23 ] アポモルフィンはDA受容体作動薬であり、これらのDA受容体において同様の活性化を引き起こす可能性がある。[ 24 ] アドレナリン受容体もDAに結合し、動脈平滑筋の収縮と心臓洞房結節伝導を増加させ、心臓に対する治療効果をもたらす。
血液脳関門は、全身循環から中枢神経系へのDAの移行を特異的に制限しますが、さらなる研究により、報酬探索行動においてDAが中心的な役割を果たしていることが明らかになりました。報酬探索行動においては、DAの移行が著しく増加します。DAに関する現在の研究には、エピジェネティックな変化と、その薬物乱用および依存症、統合失調症、注意欠陥障害など、様々な精神疾患への関与が含まれています。[ 25 ],[ 26 ] 一般的に、これらの疾患は中脳辺縁系および中脳皮質のDA経路の障害を伴います。中枢神経系における依存性薬物の一般的な影響の一つは、線条体におけるDA放出の増加であり、これは通常、運動活動の増加や常同行動と関連しています。 [ 27 ] 線条体におけるDAの増加は、黒質緻密部(SN)と腹側被蓋野(VTA)から直接発生した軸索投射の結果であり、それぞれ側坐核と扁桃体に投射します。[ 28 ],[ 29 ]
もう 1 つの DA 回路である隆起漏斗状経路は、乳汁分泌の誘発因子としての役割で知られる下垂体前葉からの神経内分泌プロラクチンの調節を主に担っていますが、水と塩分の恒常性、免疫応答、および細胞周期の調節にも小さな役割を果たしています。[ 30 ],[ 31 ] 黒質線条体経路は、パーキンソン病で観察される運動障害に関与する主要な経路です。[ 32 ] この経路には、黒質 (緻密部) に由来し、内側前脳束を経由して線条体に投射し、それぞれ被殻、尾状核、淡蒼球内 (GPi)、および視床下核 (STN) の複数のニューロン集団とシナプスを形成しているドーパミン作動性ニューロンが関与しています。この精巧なネットワークは、黒質から運動に関与する回路、すなわち基底核への求心性結合を形成します。後者において、ドーパミン受容体(DA)は運動制御と新しい運動技能の学習において重要な役割を果たします。[ 33 ]
投薬および投与
禁忌
心臓または循環器疾患の患者には、静脈内ドパミン投与は禁忌です。これらの疾患には、心室性不整脈および頻脈、血管閉塞、低血中酸素濃度、血液量減少、アシドーシス、および褐色細胞腫などの高血圧につながる副腎機能不全が含まれます。モノアミン酸化酵素阻害薬による治療を受けたばかりの患者には、DAを最初は分割投与(通常投与量の10分の1)し、その後の作用を注意深く監視する必要があります。βアドレナリン受容体阻害薬およびαアドレナリン受容体阻害薬などの高血圧治療薬は、DAの治療効果を打ち消します。ハロペリドールもDAの全身作用を阻害します。抗てんかん薬フェニトインは、DAと併用すると低血圧を引き起こし、心拍数を減少させることが報告されています。一方、三環系抗うつ薬は、シクロプロパンやハロゲン化物などの麻酔薬と同様に、DA反応を増強します。オキシトシンと併用すると、DAの使用は慢性高血圧につながる可能性があり、脳血管障害を引き起こす可能性もあります。[ 34 ]
副作用 ドーパミン
ドパミンの投与は腎機能に悪影響を及ぼし、排尿増加や不整脈を引き起こす可能性がある。[ 35 ] 過剰投与は脳内の血圧上昇により脳血管発作などの危険な状態を引き起こす可能性がある。[ 36 ]
前述のように、神経伝達物質ドーパミンは中枢中脳皮質辺縁系経路にも作用し、報酬および恐怖の処理、注意の集中、複雑な計画を含む実行機能にも関与しています。全身性ドーパミンは血液脳関門を通過しませんが、中枢性ドーパミンは眠気、統合失調症、依存症、衝動制御障害に関与しています。[ 37 ] パーキンソン病の治療に高用量のL-DOPAを使用している神経疾患患者は、中枢神経系経路におけるドーパミンの調節異常により、このような生理学的変化を経験する可能性があります。
保管条件
光から保護された場所。
特別な指示
血圧と尿流のモニタリングは必須であるが、リズムを含む心拍出量や肺楔入圧などのより複雑な血行動態パラメータのモニタリングも推奨される。血液脳関門を通過するドパミン作動薬およびドパミン模倣薬は、依存症関連の報酬系、衝動制御機構、覚醒など、運動機能、実行機能、および大脳辺縁系の機能に関与する神経回路と相互作用する点に留意する必要がある。したがって、ドパミン作動薬療法の中止は、ドパミン作動薬離脱症候群と呼ばれる状態につながる可能性がある。この状態には、不安、抑うつ、パニック発作、疲労、低血圧、吐き気、易刺激性、さらには自殺念慮など、幅広い症状がある。[ 43 ]したがって、患者はこれらの中枢作用性ドパミン作動薬を徐々に離脱することが推奨される。
賞味期限
賞味期限は2年です。
ドーパミン欠乏症
運動や感覚運動機能への関与におけるドーパミンの役割を検証した研究は数多く存在する。したがって、薬理学的介入や遺伝子治療を行わずにドーパミン作動性終末におけるドーパミン欠乏、すなわちドーパミン受容体の枯渇が起こると、これらの機能の多くに欠陥が生じることが示唆される。[ 44 ]
過剰なドーパミン
この場合、この現象を例を用いて考察する必要があります。ある人がダイエットを始め、始めたことを最後までやり遂げようと決意します。しかし、美味しいケーキが目の前に現れ、すべてが終わります。こうして、その人は自己制御を放棄してしまいます。彼には「幸せホルモン」が必要であり、この甘い喜びこそがそれを「引き起こす」のです。ですから、ケーキを一つ食べ、そしてもう一つ食べると、その人はもう止められなくなってしまいます。こうして、ドーパミンが過剰に分泌されるのです。これは別に悪いことではありません。しかし、止めるのは非常に難しいのです。
結局のところ、人生の新たな「甘味料」に「依存」してしまうと、コントロールすることは不可能になります。人はもはやそうすることができなくなります。同じことを繰り返し、結果として太ったり健康状態が悪化したりします。すべては、まさにこの幸福ホルモンがどのような役割を果たすかにかかっています。
ドーパミンは意識的な活動の多くの側面に影響を与えます。ドーパミンのレベルを下げ、過剰にならないようにする必要があります。しかし、これは「危険」にもなり得ます。衝動性の低下は、同様に重要な他の機能に悪影響を及ぼす可能性があるからです。
ドーパミン再取り込み阻害剤
ドパミン再取り込み阻害薬(DRI)は、ドパミントランスポーター(DAT)の働きを阻害することで、モノアミン神経伝達物質であるドパミンの再取り込みを阻害する薬剤の一種です。再取り込み阻害は、シナプス後ニューロンに取り込まれなかった細胞外ドパミンがシナプス前ニューロンに再流入するのを阻害することで達成されます。その結果、細胞外ドパミン濃度が上昇し、ドパミン作動性神経伝達が促進されます。[ 48 ]
ドパミン再取り込み阻害薬は、精神刺激作用のため注意欠陥多動性障害(ADHD)やナルコレプシーの治療に、また食欲抑制作用のため肥満症や過食症の治療に用いられます。気分障害の治療では抗うつ薬として用いられることもありますが、強力なドパミン再取り込み阻害薬は乱用される可能性が高く、使用には法的規制があるため、抗うつ薬としての使用は制限されています。ドパミン再取り込みの欠如と細胞外ドパミン濃度の上昇は、ドパミン神経伝達が亢進した際の依存性行動への感受性の上昇と関連付けられてきました。ドパミン経路は報酬中枢で強力であると考えられています。コカインなどの多くのドパミン再取り込み阻害薬は、脳内のシナプスドパミン濃度の上昇によって生じる報酬効果のため、乱用薬物となっています。
以下の薬剤はDRI活性を有し、この特性のために臨床的に使用されている、または現在使用されています:アミネプチン、デキスメチルフェニデート、ジフェメトレックス、フェンカムファミン、レフェタミン、レボファセトフェノン、メディフォキサミン、メソカルブ、メチルフェニデート、ノミフェンシン、ピプラドロール、プロリンタン、およびピロバレロン。以下の薬剤は臨床的に使用されている、または現在使用されていますが、DRI活性は弱く、臨床的に重要であるかどうかは不明です:アドラフィニル、アルモダフィニル、ブプロピオン、マジンドール、モダフィニル、ネファゾドン、セルトラリン、およびシブトラミン。
ドーパミン遮断薬
多くの無条件行動および条件付け行動の発現は、D1受容体拮抗薬およびD2受容体拮抗薬によって阻害される可能性がある。例えば、D1受容体拮抗薬およびD2受容体拮抗薬は、運動量 [ 49 ]、[ 50 ]、[ 51 ] および欲求動機付けオペラント行動の頻度を低下させる。[ 52 ]、[ 53 ]、[ 54 ]、[ 55 ] しかし、行動発現の少なくとも1つの側面、すなわち行動の持続時間は、D2受容体拮抗薬によって(D1受容体拮抗薬と比較して)比較的特異的に調節されるようである。
我々は以前、全身性D1受容体遮断が条件刺激(CS)が接近反応を誘発する試行の割合を減少させることを観察したが、この効果はD2受容体遮断後には観察されなかった。[ 56 ] 他の研究も同様に、手がかり反応発現はD1[ 57 ]受容体遮断によって損なわれるがD2[58 ]、[ 59 ]受容体遮断では損なわれないことが報告されている。ただし、いくつかの研究ではD2拮抗薬によって手がかり反応発現の障害が観察されている。[ 60 ]、[ 61 ]
ドーパミン交換
ドーパミンがどのように交換されるかご存知ですか?現在、ドーパミン作動性作用を持つ薬剤の探索が活発に行われています。ドーパミンが慢性的に欠乏すると、受容体の機能状態に様々な変化が生じる可能性があります。
長期治療はドーパミン受容体に不可逆的な変化を引き起こす可能性があります。しかし、シナプス前ニューロンの進行性変性を止めることはできません。そのため、シナプス後受容体を刺激し、治療への反応性を高める特別な手段の探索が行われました。これにはドーパミン作動薬が含まれます。しかし、懸念事項もいくつかあります。ドーパミン作動薬を長期使用すると、チロシン水酸化酵素の活性が阻害される可能性があります。
 [ 62 ], [ 63 ], [ 64 ], [ 65 ], [ 66 ], [ 67 ]
[ 62 ], [ 63 ], [ 64 ], [ 65 ], [ 66 ], [ 67 ]
ドーパミン産生
科学者たちは、喜びをもたらすあらゆる活動が幸福ホルモンの分泌につながることを証明しました。つまり、人が何をするかは全く重要ではなく、重要なのはそれが自分を幸せにしてくれるかどうかです。しかし、当然のことながら、活動は適度な範囲内であるべきです。喜びを一切排除すると、ドーパミンのレベルが著しく低下し、うつ病に陥る可能性があります。
ドーパミンはある種の薬物依存症と関連付けられていることを理解する必要があります。ケーキ好きの人は、気分を良くするためにケーキを絶えず食べます。これは、健康状態の悪化や体重増加など、他の問題につながります。「喜び」を奪ってしまうと、憂鬱な気分になり、気分が悪化します。最終的には悪循環に陥ります。したがって、より有益な活動を選択する必要があります。
ドーパミンの「生成」を促す最も簡単で楽しい方法は、定期的にセックスをすることです。ただし、それが本当に快感をもたらす場合に限ります。
 [ 68 ], [ 69 ], [ 70 ], [ 71 ]
[ 68 ], [ 69 ], [ 70 ], [ 71 ]
ドーパミンと統合失調症
ドーパミン仮説の起源は、2つの証拠に遡ります。第一に、臨床研究によって、ドーパミン作動薬および刺激薬が健常者に精神病を誘発し、統合失調症患者の精神病を悪化させることが立証されました。[ 72 ] 第二に、抗精神病薬がドーパミン系に影響を及ぼすことが発見されました。[ 73 ] その後、抗精神病薬の有効性はドーパミンD2受容体への親和性と関連付けられ、分子作用と臨床表現型が結び付けられました。[ 74 ]
死後研究では、脳におけるドーパミン作動性機能障害とその解剖学的局在に関する最初の直接的な証拠が得られました。統合失調症患者の線条体において、ドーパミン、その代謝物、および受容体の濃度が上昇していることが示されました。[ 75 ]、[ 76 ] しかし、これらの研究は抗精神病薬を服用していた患者を対象としていました。そのため、機能障害が疾患の発症または末期に関連しているのか、あるいは抗精神病薬の影響と関連しているのかは不明でした。
 [ 77 ], [ 78 ], [ 79 ], [ 80 ], [ 81 ], [ 82 ], [ 83 ], [ 84 ], [ 85 ], [ 86 ]
[ 77 ], [ 78 ], [ 79 ], [ 80 ], [ 81 ], [ 82 ], [ 83 ], [ 84 ], [ 85 ], [ 86 ]
ドーパミンとドーパミン
つまり、これらの物質に違いはありません。本質的には同じだからです。この物質は体内で生成され、神経伝達物質として機能します。簡単に言えば、脳細胞が特定のメッセージを伝達するのを助けます。俗に「幸福ホルモン」と呼ばれています。
ドーパミンの生成は、活動量の急増、気分の高揚、エネルギーレベルの向上、記憶力と注意力の向上につながります。実際、多くの利点があります。注目すべきは、この物質は生活の「甘味料」の影響下で生成されるということです。これは食べ物や運動など、様々な形で現れます。簡単に言えば、人を幸せにするものはこのホルモンの生成を刺激します。ですから、完全な満足感をもたらすことを、もっと頻繁に行う必要があるのです。
ドーパミンとドーパミンは同じ物質であり、同じ働きをします。喜びのホルモンのレベルを維持することが重要であり、それによって人生はより充実したものになります。
アルコールがドーパミン系に与える影響
側坐核(NAc)殻に情報を伝達するドーパミン作動性ニューロンは、アルコールに対して極めて敏感です。例えば、ラットの研究では、体重1kgあたり2~4mgのアルコールを血中に投与すると、NAc殻におけるドーパミン放出が増加し、慢性的なアルコール自己投与が促進されました。[ 89 ] ラットでは、経口アルコール摂取もNAcにおけるドーパミン放出を刺激します。[ 90 ] しかし、この投与経路では、血液に直接アルコールを注入するよりも、同じ効果を得るためにより多くのアルコールが必要になります。[ 91 ]
アルコールによるNAcにおけるドーパミン放出の刺激には、別のカテゴリーの神経調節物質である内因性オピオイドペプチドの活性が必要である可能性がある。この仮説は、内因性オピオイドペプチドの作用を阻害する化学物質(すなわち、オピオイドペプチド拮抗薬)が、アルコールによるドーパミン放出への影響を阻害するという観察によって裏付けられている。オピオイドペプチド拮抗薬は、主にNAcに投射するドーパミン作動性ニューロンの起始部である脳領域に作用する。これらの観察結果は、アルコールが内因性オピオイドペプチドの活性を刺激し、間接的にドーパミン作動性ニューロンの活性化につながることを示唆している。オピオイドペプチド拮抗薬はこのプロセスを阻害し、ドーパミン放出を抑制する可能性がある。
アルコールの強化剤としての効果:ドーパミンの役割
ドーパミンシグナル伝達を操作することでアルコール強化におけるドーパミンの役割を明らかにしようとする研究は数多く行われてきたが、これらの研究では確固たる結論を導き出すことはできなかった。[ 92 ]しかし、アルコールの効果と食物などの一般的な強化因子の効果を比較することで、アルコール強化を媒介するドーパミンの役割についていくつかの手がかりが得られる。
嗜好食品は、例えば特定の感覚刺激(例えば、味覚や香味)を与えることで、NAcシェルにおけるドーパミン作動性シグナル伝達を活性化します。経口摂取されたアルコールも同様に味覚受容体を活性化し、NAcにおけるドーパミン放出を増加させます。しかし、食品とは異なり、アルコールは脳に到達するとドーパミン作動性ニューロンの機能を直接変化させることができます。したがって、経口摂取されたアルコールは、その味覚特性(すなわち、従来の強化子として)と脳への直接的な作用(すなわち、薬物強化子として)の両方を通じて、NAcにおけるドーパミン放出に影響を与えます。この仮説と一致して、NAcではドーパミン放出の2つのピークが発生します。最初のピークはアルコールに関連する味覚刺激に起因し、2番目のピークは脳におけるアルコールの影響に起因します。結果として、アルコールによって誘発されるドーパミン作動性シグナル伝達の直接活性化は、アルコールに関連する味覚刺激の動機づけ特性を高める可能性があります。このメカニズムの結果、アルコールに関連する味覚刺激は強いインセンティブ特性(つまり、飲酒者にさらなるアルコールを求める動機付けとなる刺激)を獲得する。同様に、アルコールに関連する食欲刺激(例えば、特定のアルコール飲料ブランドの出現やバーの外観といった外的刺激)もインセンティブ特性を獲得し、アルコールの探求と消費を促進する。これらの複雑なメカニズムを通じて、アルコール誘発性ドーパミン放出は、アルコール消費を促進する二次強化回路を活性化する。
アルコール依存症の発症におけるドーパミンの役割
NAcシェルにおけるドーパミン放出は、アルコール依存症の発症に寄与する可能性があります。アルコールへの心理的依存は、アルコール関連刺激が過剰な動機づけ特性を獲得し、アルコール飲料を摂取したいという強い欲求(すなわち渇望)を引き起こすことで発生します。この強い渇望の結果、通常の強化因子(例えば、食べ物、性行為、家族、仕事、趣味など)は重要性を失い、飲酒者の行動への影響は小さくなります。
アルコール関連の手がかりが異常な意味を持つ原因の一つとして考えられるのは、アルコールによって引き起こされるNAcにおけるドーパミン作動性シグナル伝達の不適応性である。前述のように、通常の強化因子(例:食物)によって引き起こされるNAcシェルにおけるドーパミン放出の増強は急速に慣れにつながり、関連する刺激を繰り返し提示してもドーパミン放出は引き起こされなくなる。一方、アルコールの反復摂取後には慣れは起こらない。アルコールへの反応としてNAcシェルにおいてドーパミンが持続的に放出される結果、アルコール関連の刺激は異常な感情的・動機的意味を獲得し、飲酒者の行動に対する過剰な支配につながる。この過剰な支配こそが依存症の根幹を成すのである。
 [ 93 ], [ 94 ], [ 95 ], [ 96 ], [ 97 ]
[ 93 ], [ 94 ], [ 95 ], [ 96 ], [ 97 ]
喫煙とドーパミン
喫煙障害は、様々な環境要因と遺伝要因の影響を受けます。環境要因は、文化的、社会的、経済的側面を幅広く網羅しています。遺伝要因は、ニコチン代謝経路に関連する遺伝子(ニコチンがコチニンに代謝される速度を示す)と、報酬カスケード理論に関連する遺伝子(喫煙時に得られる快感の量)の2つの主要なグループに分けられます。ニコチン代謝に影響を与える最も重要な遺伝子は、シトクロムP450 CYP2A6とCYP2B6です。報酬カスケード理論に影響を与える遺伝子には、セロトニン、オピオイド、γ-アミノ酪酸(GABA)、ドーパミンからなる複雑なネットワークが含まれます。[ 98 ]
ドーパミン候補遺伝子と喫煙に関する研究については、こちらの記事をお読みください。
ドーパミンを増やすにはどうすればいいですか?
実際、このプロセスは何も複雑なものではありません。喜びをもたらす活動を日々の計画に取り入れるようにしてください。
しかし、それだけではありません。バナナを毎日食べることをお勧めします。バナナにはドーパミンに似た物質が含まれています。実の小さな茶色い斑点には、この有用な「物質」が多く含まれています。食事には抗酸化物質を含む食品を積極的に摂りましょう。抗酸化物質は、ドーパミンレベルを上昇させるフリーラジカルの一種です。例えば、小豆、クランベリー、アーティチョーク、イチゴ、プラム、ブルーベリーなどが挙げられます。
カフェインレスコーヒーをやめ、砂糖の摂取量を減らし、アルコール飲料の摂取量を減らすのが効果的です。アーモンドを毎日ひとつかみ食べるのがおすすめです。ヒマワリの種もおすすめです。ゴマもお勧めです。新鮮な野菜を使ったサラダやサンドイッチによく合います。
食品中のドーパミン
ドーパミンは人体において、体の動きの調整、動機づけ、報酬などに重要な役割を果たしている。ドーパミン産物の含有量に関する情報は非常に限られており、これは臨床的関心の低さが原因と考えられる。バナナやプラタナスなどのバショウ属の果物や、M. Persea americana(アボカド)には、高濃度のドーパミンが含まれている。[ 102 ] 特に、バナナの皮(700 μg/g)、バナナの果肉(8 μg/g)、アボカド(4~5 μg/g)でドーパミン濃度が検出されている。植物において、ドーパミンは保護的な役割を果たし、生殖器官形成、イオン透過性、抗酸化活性[ 103 ]、およびアルカロイドの形成に関与している。 [ 104 ] 興味深いことに、ムクナ・プルリエンスL(Mucuna pruriens L.)の葉にはドーパミンが含まれていることが示されており、[ 105 ] 種子由来製品のよく知られた抗パーキンソン病効果に関与している可能性がある。[ 106 ] Citrus sinensis L.(オレンジ)、Malus sylvestris L.(ウッドアップル)、トマト、ナス、ホウレンソウ、エンドウ豆、豆類でも低レベルのドーパミンが測定されている。脱脂粉乳の摂取後に断続的な運動障害(頭を左右に振るなど)が報告されている。同じ著者らは、これらの影響は乳製品に含まれる高L-チロシンに起因するとしている。[ 107 ] しかし、ドーパミンとの相互作用の可能性を排除することはできないが、文献データは不十分である。
注意!
情報の認識を簡素化するため、この薬物の使用説明書は、薬物の医療使用に関する公式の指示に基づいて特殊な形で翻訳され提示されています。ドーパミン
説明は情報提供の目的で提供され、自己治癒の手引きではありません。 この薬物の必要性、治療レジメンの目的、薬物の投与方法および投与量は主治医によってのみ決定される。 自己投薬はあなたの健康にとって危険です。


