チャーグ・ストラウス症候群は、この疾患を初めて報告した科学者チャーグとストラウスにちなんで名付けられました。この疾患は、アレルギー性血管炎および肉芽腫症という血管炎の一種であり、主に中小型血管を侵します。また、肺炎、好酸球増多症、気管支喘息などの病態を併発することもあります。以前は、この病態は結節性動脈周囲炎の喘息型と考えられていましたが、現在では独立した病理学的分類として区別されています。
1951年、チャーグとストラウス(Strauss)は、喘息、好酸球増多、肉芽腫性炎症、壊死性全身性血管炎、壊死性糸球体腎炎を呈する13名の患者において、この症候群を初めて報告しました。1990年、米国リウマチ学会(ACR)は、チャーグ・ストラウス症候群の診断基準として以下の6つの基準を提唱しました。
- 喘息(ゼーゼー、呼気時のゼーゼー)。
- 好酸球増多(10%以上)。
- 副鼻腔炎。
- 肺浸潤(一時的な場合もあります)。
- 血管外好酸球を伴う血管炎の組織学的証拠。
- 多発性単神経炎または多発神経障害。
4 つ以上の基準が存在する場合、特異度は 99.7% になります。
原因 チャーグ・ストラウス症候群
この症候群の原因はまだ特定されていません。発症メカニズムは、免疫炎症、破壊的および増殖的プロセス、そして血管壁の透過性の低下、血栓の形成、血管破壊および出血部位における虚血の発症に基づいています。さらに、この症候群の発症における重要な要因は、好中球酵素(主にプロテアーゼ3およびミエロペルオキシダーゼ)の抗原中和を行うANCAの力価の上昇です。同時に、ANCAは活性化顆粒球の経内皮運動を阻害し、早期脱顆粒を引き起こします。血管の変化により、臓器や組織に肺浸潤が現れ、続いて壊死性結節性炎症が発生します。
チャーグ・ストラウス症候群の発症の誘因としては、細菌またはウイルス感染(例えば、ブドウ球菌による鼻咽頭感染やB型肝炎)、さまざまなアレルゲン、特定の薬剤に対する不耐性、ワクチン接種、過度の冷却、ストレス、妊娠または出産、日光浴などが考えられます。
HLA-DRB4 の存在は、チャーグ・ストラウス症候群の発症の遺伝的危険因子である可能性があり、この疾患の血管炎症状を発症する可能性を高める可能性があります。
症状 チャーグ・ストラウス症候群
結節性動脈周囲炎においても観察される非特異的な症状(発熱、食欲不振、体重減少、倦怠感)に加え、主な症状は肺機能の障害です。その結果、重度の気管支喘息が発症し、胸部X線検査で確認される肺の黒化が起こりますが、これはしばしばすぐに消失します(揮発性ELI)。
この病態の主な症状の一つにGRB症候群があり、これは通常、全身性血管炎の臨床徴候の出現の前兆となります。また、感染性肺疾患の併発もしばしば観察され、それに続いて感染依存性気管支喘息や気管支拡張性疾患が発症します。この症候群の患者の3分の2に肺浸潤が認められます。患者の約3分の1は、胸水中の好酸球数の増加を伴う胸膜炎と診断されます。
消化管が侵されると、腹痛、下痢、そしてまれに出血が現れ始めます。これらの症状の発現は、好酸球性胃腸炎または腸壁の血管炎によって引き起こされます。後者は、腹膜炎、腸壁の完全な破壊、または腸閉塞を引き起こす可能性があります。
心臓疾患の臨床症状は全患者の3分の1に現れますが、剖検で62%の症例で発見され、23%の症例で死因となっています。心電図所見の様々な変化は、患者の約半数に認められます。本疾患の約3分の1の症例では、心不全または急性または収縮性の心膜炎を併発します。まれに、血圧上昇や心筋梗塞を呈する患者もいます。
患者の70%に皮膚疾患が認められますが、SCSでは結節性動脈周囲炎よりも皮膚疾患が一般的です。主な症状としては、以下のものがあります。
- 出血性の発疹;
- 皮膚の上と下のリンパ節。
- 皮膚の赤み;
- じんましん;
- 皮膚の微小膿瘍;
- 網状皮斑。
腎臓病は最も頻度の低い症状です。しかし、ウェゲナー肉芽腫症や結節性動脈周囲炎ほど危険ではありません。この症候群の患者の約半数は局所性腎炎を患っており、しばしば動脈性高血圧を引き起こします。血漿中に抗好中球抗体を持つ患者は、壊死性糸球体腎炎を発症する可能性があります。
この症候群の患者の半数に、関節疾患(多発性関節痛や多発性関節炎など)がみられます。通常は非進行性の移動性関節炎を発症し、小関節と大関節の両方に影響を及ぼします。場合によっては、筋炎や筋肉痛が観察されます。
合併症とその結果
この病気の合併症の中で最も危険なのは、ニューモシスチス・カリニの影響下で発症する肺炎です。
SCSは、心臓、肺、皮膚、消化管、筋肉、関節、腎臓など、様々な臓器に影響を及ぼすため、非常に危険な病気です。治療せずに放置すると、死に至る可能性があります。起こりうる合併症:
- 末梢神経機能の障害;
- 皮膚のかゆみや潰瘍、感染性合併症。
- 心膜の炎症、心筋炎の発症、さらには心不全や心臓発作。
- 糸球体腎炎は、腎臓の濾過機能が徐々に失われ、腎不全に陥る病気です。
リスク層別化
フランス血管炎研究グループは、臨床的特徴を用いてチャーグ・ストラウス症候群の死亡リスクを予測する5点(5因子)システムを開発しました。これらの因子は以下のとおりです。
- 腎機能低下(クレアチニン > 1.58 mg/dLまたは140 μmol/L)
- タンパク尿(> 1g/24時間)
- 消化管出血、心臓発作、または膵炎
- 中枢神経系の損傷
- 心筋症
これらの因子のいずれかが欠如している場合は、病状が比較的軽度であることを示し、5年死亡率は11.9%です。因子が1つ存在する場合は重症であることを示し、5年死亡率は26%です。また、因子が2つ以上存在する場合は、非常に重症であることを示し、5年死亡率は46%です。
診断 チャーグ・ストラウス症候群
主な診断基準には、好酸球増多、気管支喘息、アレルギー歴などの症状があります。さらに、好酸球性肺炎、神経障害、副鼻腔炎、血管外好酸球増多も診断基準となります。これらの疾患のうち4つ以上を有する場合、SCSと診断されます。
 [ 31 ], [ 32 ], [ 33 ], [ 34 ]
[ 31 ], [ 32 ], [ 33 ], [ 34 ]
テスト
血液を採取して一般的な分析を行います。この病気を診断するには、好酸球が正常値より 10% 多く存在し、赤血球沈降プロセスが加速している必要があります。
一般的な尿検査では、尿中にタンパク質が存在することと、赤血球数の増加が明らかになるはずです。
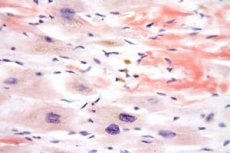
経気管支、皮膚および皮下組織の生検:この場合、小血管の壁への顕著な好酸球浸潤と、呼吸器官の壊死性肉芽腫性プロセスが検出されるはずです。
ANCA抗体レベルの上昇を検出するための免疫学的分析。ここでは、総IgE抗体と抗ミエロペルオキシダーゼ活性を有する核周縁抗体の上昇に焦点を当てます。
機器診断
肺の CT スキャン – この検査では、主に末梢に位置する実質のクラスターが視覚化されます。また、気管支の壁が厚くなり、一部の場所では拡張していることもわかり、気管支拡張症が顕著になります。
胸水中の滲出液の顕微鏡検査、および好酸球増多を検出するための治療的気管支鏡検査。
心エコー検査を実施して、僧帽弁逆流の症状や、心筋の瘢痕の出現を伴う結合組織の増殖を検出します。
連絡先
処理 チャーグ・ストラウス症候群
SCSの治療は複雑で、治療過程では細胞増殖抑制薬とグルココルチコステロイドが使用されます。一般的に、治療の原則は結節性動脈周囲炎の治療と同様です。
薬物治療
胃腸管、肺、腎臓、皮膚に損傷がある場合は、プレドニゾロンによる治療を開始する必要があります。治療量は1日60mgです。1~2週間の投与後、徐々に減量しながらプレドニゾロンの定期投与に移行します。3ヶ月後に症状の改善が認められた場合は、投与量をさらに減量し、維持量まで減量した後、長期間維持します。
プレドニゾロンが効果を発揮しない場合、またびまん性中枢神経障害、血流不全、伝導障害などの症状が認められる場合は、ヒドロキシウレアを0.5~1g/日の用量で内服します。白血球数が6~10×109/Lに減少した場合は、2日おきの投与に変更するか、3日目に投与するか、2~3ヶ月間休薬する必要があります。シクロホスファミドやアザチオプリンなどの他の細胞増殖抑制薬も使用できます。
患者が気管支喘息の場合、気管支拡張薬が処方されます。
抗凝固剤または抗血小板剤(アセチルサリチル酸 0.15~0.25 g/日、またはキュランチル 225~400 mg/日の投与量など)は、血栓塞栓症の合併症の発症に対する予防策として使用されます。
2007 年に実施された体系的なレビューでは、高用量ステロイドの有効性が示されました。
ビタミン
コルチコステロイドは骨の強度に悪影響を与えるため、必要な量のカルシウムを摂取して失われた分を補うとともに、1日あたり約2000 IUのビタミンDを摂取する必要があります。


