B 型肝炎の発病においては、発病連鎖の主要なリンクがいくつか特定できます。
- 病原体の導入 - 感染;
- 肝細胞への固定および細胞内への浸透;
- ウイルスの増殖と肝細胞表面および血液中への「押し出し」。
- 病原体を排除することを目的とした免疫反応の活性化。
- 免疫複合体による臓器や器官への損傷;
- 免疫の形成、病原体からの解放、回復。
B型肝炎の感染は常に非経口的に起こるため、感染の瞬間は実質的にウイルスが血液中に侵入した瞬間と同義であると考えられます。一部の研究者はB型肝炎の腸管期と局所期を区別しようと試みていますが、その根拠は乏しいです。ウイルスが血流に乗ってすぐに肝臓に侵入すると考える根拠はより多くあります。
B型肝炎ウイルスの肝組織への親和性は、HBsAgに存在する特殊な受容体(分子量31,000 Da(P31)のポリペプチド)によって決定されます。このポリペプチドはアルブミン結合活性を有します。同様のアルブミン領域はヒトとチンパンジーの肝臓の肝細胞膜にも存在し、これがヒトとチンパンジーの肝臓へのHBVの親和性を本質的に決定づけています。
ウイルスが肝細胞に侵入すると、ウイルスDNAが放出されます。これは肝細胞の核に入り込み、核酸合成の基質として働き、一連の生物学的反応を引き起こします。その結果、ウイルスのヌクレオカプシドが形成されます。ヌクレオカプシドは核膜を通過して細胞質へ移行し、そこでデーン粒子、すなわちB型肝炎ウイルス全体が最終的に組み立てられます。
ただし、肝細胞が感染すると、その過程は複製型と統合型の2つの方法で進行する可能性があることに留意する必要があります。前者の場合、急性または慢性肝炎の症状が現れ、後者の場合、ウイルス保有が起こります。
ウイルスDNAと肝細胞の間の2種類の相互作用を決定する要因は、正確には解明されていません。おそらく、反応の種類は遺伝的に決定されていると考えられます。
複製相互作用の結果、核抗原構造(核内)の組み立てと完全なウイルスの組み立て(細胞質内)が行われ、その後、完全なウイルスまたはその抗原が膜上または肝細胞膜の構造内に提示されます。
B型肝炎ウイルスは細胞変性効果を持たないため、ウイルス複製は肝細胞レベルで細胞損傷をもたらさないことが一般的に認められています。しかし、この見解は議論の余地のないものではありません。なぜなら、B型肝炎ウイルスの細胞変性効果が存在しないことを示唆する実験データは、組織培養で得られたものであり、ヒトにおけるB型肝炎ウイルス感染に完全に外挿することはできないからです。いずれにせよ、複製期における肝細胞損傷の欠如については、さらなる研究が必要です。
しかし、ウイルスと細胞の相互作用の性質に関わらず、肝臓は必然的に免疫病理学的過程に関与します。この場合、肝細胞への損傷は、肝細胞膜上でのウイルス抗原の発現と自由循環へのウイルス抗原の放出の結果として、一連の細胞性および体液性免疫反応が連続的に起こり、最終的にはウイルスを体内から排除することを目指します。このプロセスは、ウイルス感染に対する免疫応答の一般的なパターンに完全に準拠して行われます。病原体を排除するために、K細胞、T細胞、ナチュラルキラー、マクロファージといった様々なクラスのエフェクター細胞を介した細胞傷害性反応が関与します。これらの反応中に、感染した肝細胞は破壊され、ウイルス抗原(HBc抗原、HBe抗原、HBs抗原)が放出されます。これらの抗原は抗体産生系を活性化し、その結果、主にコア抗原である抗HBc抗体とe抗原である抗HBE抗体に対する特異的抗体が血中に蓄積します。その結果、細胞溶解の反応により肝細胞が死滅する過程で、ウイルスからの解放が起こります。
同時に、血液中に蓄積した特異抗体がウイルス抗原と結合し、免疫複合体を形成します。この複合体はマクロファージによって貪食され、腎臓から排出されます。この場合、糸球体腎炎、動脈炎、関節痛、皮膚発疹などの様々な免疫複合体病変が発生する可能性があります。特異抗体の作用により、体内から病原体が排除され、完全に回復します。
B型肝炎の病態に関する概説によれば、病状の経過における臨床的変異の多様性は、通常、ウイルスの相互作用と免疫担当細胞の連携の特殊性、すなわちウイルス抗原の存在に対する免疫応答の強さによって説明されます。現代の概念によれば、免疫応答の強さは遺伝的に決定され、HLA第一クラスの遺伝子座の組織適合性抗原と関連しています。
ウイルス抗原に対する適切な免疫応答が維持されている場合、急性肝炎は臨床的に周期的な経過を辿り、完全に回復することが一般的に認められています。ウイルス抗原に対する免疫応答の低下を背景に、免疫介在性細胞溶解はわずかしか発現せず、感染肝細胞の有効な排除が達成されません。その結果、軽度の臨床症状が発現し、ウイルスは長期にわたり持続し、慢性肝炎を発症する可能性があります。一方、遺伝的に決定された強力な免疫応答と大量感染(輸血)の場合、広範囲にわたる肝細胞損傷が生じ、これは臨床的には重篤で悪性の疾患に相当します。
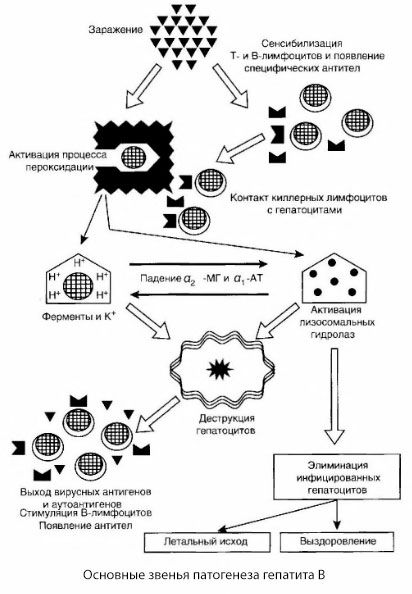
提示された B 型肝炎の病因の図は、その一貫性によって特徴付けられますが、議論の余地があり、十分に研究されていない点も数多く含まれています。
B型肝炎を免疫病理学的疾患と捉えるならば、疾患の重症度が増すにつれて細胞性細胞傷害反応が増加すると予想されます。しかし、重症型では、細胞間免疫の指標が急激に低下し、健康な小児と比較して数倍の低下やK細胞細胞傷害指数の低下が見られます。悪性型では、広範囲の肝壊死、特に肝性昏睡の発症期に、フィトヘマトチニン、ブドウ球菌エンドトキシン、およびHBs抗原の影響下でリンパ球が芽球化できないことが観察されます。さらに、白血球遊走抑制反応(LMIC)による白血球遊走能は消失し、蛍光テトラサイクリンプローブを用いた研究結果から、リンパ球膜の透過性が急激に上昇することが明らかになっています。
例えば、健常者のリンパ球の蛍光指数が9.9±2%であるのに対し、良性の経過をたどる典型的なB型肝炎では22.3±2.7%に増加するのに対し、悪性型では蛍光リンパ球の数は平均63.5±5.8%に達します。細胞膜透過性の増加は、文献において機能低下の信頼できる指標として明確に評価されているため、B型肝炎、特に悪性型では、リンパ球に著しい損傷が生じていると結論付けることができます。これは、K細胞の細胞傷害性指数によっても裏付けられています。重症型では、発症後 1~2 週目の細胞毒性は 15.5±8.8% ですが、悪性型では発症後 1 週目が 6.0±2.6%、2 週目が 22.0±6.3% で、正常範囲は 44.8±2.6% です。
提示されたデータは、重症の B 型肝炎患者の免疫細胞間のつながりに顕著な障害があることを明確に示しています。また、毒性代謝物、およびおそらくは循環する免疫複合体による免疫担当細胞の損傷の結果として、これらの変化が二次的に発生することも明らかです。
研究結果によると、重症のB型肝炎患者、特に広範囲の肝壊死を発症した場合、血清中のHBs抗原およびHBe抗原の力価が減少し、同時に表面抗原に対する抗体が高力価で検出され始めます。これは、抗HBV抗体が病気の3~5か月目にのみ現れる良性のB型肝炎ではまったく見られない特徴です。
B 型肝炎ウイルス抗原が急速に消失し、同時に高力価の抗ウイルス抗体が出現することは、免疫複合体が集中的に形成され、それが広範囲の肝壊死の発症の病因に関与している可能性を示唆しています。
したがって、事実資料だけでは、B型肝炎を免疫病理学的侵襲性という観点からのみ明確に解釈することはできません。肝形態変化の深さと頻度と、細胞性免疫因子の重症度との間に関連性が見られないという点だけが問題なのではありません。理論的には、この状況は、細胞性免疫指標の研究が後期段階に入ったことで説明できる可能性があります。この段階では、肝機能不全の進行により免疫担当細胞が強力な毒性作用にさらされていました。もちろん、肝細胞の免疫細胞溶解は感染過程の最も初期段階、おそらくは重篤な肝障害の臨床症状が現れる前でさえ起こると考えられます。しかし、このような仮定はありそうにありません。なぜなら、病気の最も急性(電撃的)経過をたどる患者では細胞性免疫の同様の指標が検出され、さらに、肝臓組織の形態学的検査中に大量のリンパ球浸潤は検出されなかった一方で、吸収やリンパ球の攻撃の現象なしに壊死上皮の連続領域が検出されたからです。
急性肝炎の形態学的像を免疫細胞溶解の観点からのみ説明するのは非常に困難であるため、初期の研究では、B型肝炎ウイルスの細胞毒性効果が排除されていませんでした。
現在、この仮説はB型肝炎ウイルスの発見によって部分的に裏付けられています。研究結果によると、D型肝炎マーカーの検出頻度は疾患の重症度に直接依存しており、軽症では14%、中等症では18%、重症では30%、悪性では52%の患者で検出されています。D型肝炎ウイルスが壊死性細胞変性作用を有することを考慮すると、B型肝炎ウイルスとD型肝炎ウイルスの重複感染が劇症型B型肝炎の発症に非常に重要であることは既に確立されていると考えられます。
B型肝炎の病態は以下のように説明できます。B型肝炎ウイルスが肝細胞に侵入すると、Tキラー細胞が感染肝細胞に対して免疫学的攻撃を誘導し、肝細胞に向けてリンホトキシンを分泌します。
B型肝炎における肝細胞障害の詳細なメカニズムは未だ解明されていません。その主役は、脂質過酸化反応とリソソーム加水分解酵素の活性化です。エフェクター細胞が肝細胞と接触した際に放出されるリンホトキシンが引き金となる可能性はありますが、ウイルス自体が過酸化反応の開始因子となる可能性もあります。その後、病理学的プロセスは、おそらく以下の順序で進行していくと考えられます。
- 攻撃因子(リンホトキシンまたはウイルス)と生物学的高分子(四塩化炭素に関連して示されているように、他の損傷因子との類推により、解毒プロセスに参加できる小胞体膜の成分との相互作用の可能性あり)
- フリーラジカルの形成、脂質過酸化プロセスの活性化、およびすべての肝細胞膜の透過性の増加(細胞溶解症候群)。
- 濃度勾配に沿った生物活性物質の移動 - さまざまな細胞内局在の酵素、エネルギー供与体、カリウムなどの損失。細胞内のナトリウムとカルシウムの蓄積、細胞内アシドーシスへの pH の変化。
- リソソーム加水分解酵素(RNAse、DNAse、カテプシンなど)の活性化と放出により、肝細胞が分解され、自己抗原が放出されます。
- T リンパ球と B 免疫系が刺激され、肝臓リポタンパク質に対する T リンパ球の特異的感作が形成され、また抗肝体液性自己抗体が形成されます。
提案されているB型肝炎の発症機構では、ウイルス抗原が誘因であり、その集中的な産生は病気の初期段階から急性期全体にわたって観察されますが、悪性型の場合は例外で、ウイルス抗原の産生は広範囲の肝壊死の発症時に実質的に停止し、ウイルス複製の急速な減少が事前に決定されます。
ウイルス抗原がT細胞系とB細胞系の免疫系を活性化することも明らかです。このプロセスにおいて、適切な免疫応答の組織化、感染肝細胞の排除、ウイルス抗原の中和、心筋梗塞の予防、そして回復を目的として、Tリンパ球サブポピュレーションの特徴的な再分配が起こります。
免疫担当細胞が肝細胞膜上のウイルス抗原と相互作用するか、または肝細胞内でウイルスが増殖すると、脂質過酸化プロセスが活性化される条件が生じ、これがすべての細胞膜と細胞内膜の透過性を制御することが知られています。
この立場からすると、細胞膜の透過性が高まる細胞溶解症候群の発生は、非常に自然であり、ウイルス性肝炎の特徴であることが理解できるようになります。
細胞溶解症候群の最終的な結果は、酸化リン酸化の完全な分離、細胞物質の漏出、および肝実質の死である可能性があります。
しかし、ほとんどの場合、これらのプロセスはそれほど致命的な進展には至りません。悪性型の疾患においてのみ、病理学的プロセスは雪崩のように不可逆的に進行し、大規模な感染、顕著な免疫プロセス、過酸化プロセスおよびリソソーム加水分解酵素の過剰な活性化、そして自己免疫攻撃現象が発生します。
B型肝炎の良好な経過においても同様のメカニズムが観察されますが、唯一の特徴は、それらが質的に異なるレベルで発現されることです。広範囲の肝壊死とは異なり、疾患の良好な経過においては、感染肝細胞の数、ひいては免疫病理学的細胞溶解領域は小さく、脂質過酸化反応はそれほど顕著に促進されず、酸性加水分解酵素の活性化は自己抗原の放出を伴わない限定的な自己溶解のみを引き起こします。したがって、広範囲の自己攻撃は発生しません。つまり、良好な経過における病態の全段階は、肝実質の保存された構造組織の枠組み内で進行し、防御システム(抗酸化物質、阻害剤など)によって抑制されるため、それほど破壊的な影響はありません。
ウイルス性肝炎における中毒症状の原因は、十分に研究されていません。いわゆる一次性(ウイルス性)中毒と二次性(交換性、代謝性)中毒を区別するという提案は肯定的であると考えられますが、全身性中毒症候群の発生メカニズムの詳細は明らかにされていません。第一に、肝炎ウイルスには毒性がなく、第二に、多くの代謝物の濃度は、必ずしも疾患の重症度や中毒症状の発現程度と相関するわけではありません。また、ウイルス抗原の濃度は中毒の重症度と厳密に相関しないことも知られています。むしろ、疾患の重症度、つまり中毒度の上昇に伴い、HBsAg濃度は低下し、悪性型では深部肝性昏睡の発症時に最も低くなります。同時に、特異的抗ウイルス抗体の検出頻度と力価は、疾患の重症度に直接依存します。
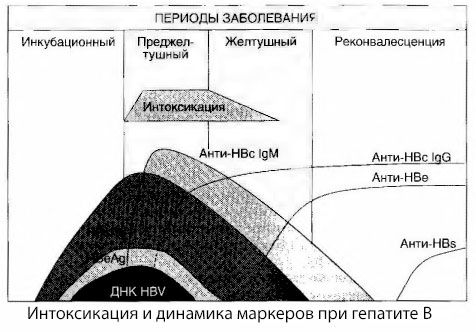
中毒はウイルス抗原の検出時に発現するのではなく、牛抗原およびE抗原に対するIgMクラスの抗ウイルス抗体が血中に循環する期間に発現します。さらに、重症型、特に悪性型の患者では、かなりの割合の患者で血中に抗HBs抗体が認められますが、これは軽症および中等症の疾患では通常認められません。
提示されたデータから、ウイルス性肝炎、特にB型肝炎における中毒症候群は、血液中のウイルス抗原の出現によって生じるのではなく、ウイルス抗原とIgMクラスの抗ウイルス抗体との相互作用によって生じると結論付けられます。このような相互作用の結果、免疫複合体が形成され、活性毒素が形成される可能性があります。
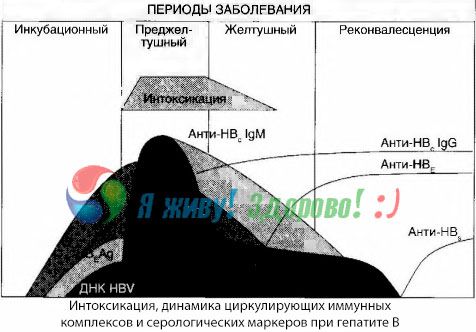
中毒の症状は、自由循環中に免疫複合体が出現した瞬間に発生しますが、その後はそのような相関関係は観察されません。
この現象の一部は、免疫複合体の組成に関する研究で説明できます。重症患者では、主に中サイズの複合体が血中を循環しており、その組成において、中毒症候群のピーク時にはIgGクラスの抗体が優勢となりますが、臨床症状の軽減期および回復期には複合体は大きくなり、その組成においてIgGクラスの抗体が優勢になります。
提示されたデータは、病気の初期段階における中毒性症候群の発症のメカニズムに関するものですが、臨床症状のピーク時に発生する中毒症、特に肝性昏睡の発症においては、その重要性は部分的にすぎません。
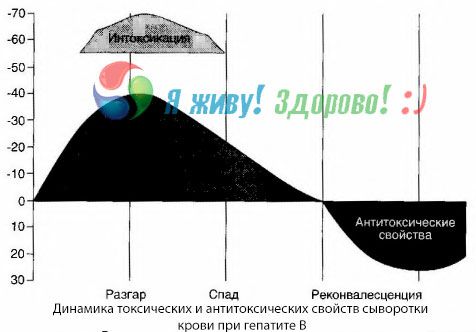
血液培養法によって、B型肝炎では、損傷し腐敗した肝組織から放出された毒素が血液中に絶えず蓄積することが示されています。これらの毒素の濃度は病気の重症度に比例し、タンパク質の性質を持ちます。
回復期には、この毒素に対する抗体が血液中に現れますが、肝性昏睡に陥ると、血液中の毒素濃度が急激に上昇し、血液中に抗体は検出されません。
B型肝炎の病理形態学
形態学的変化の性質に基づいて、急性 B 型肝炎は 3 つの形態に分類されます。
- 循環形式、
- 広範囲の肝壊死;
- 胆汁うっ滞性胆管周囲溶解性肝炎。
B型肝炎の周期型では、ジストロフィー、炎症、増殖性変化が小葉の中心部でより顕著であるのに対し、A型肝炎では、これらの変化は小葉の周縁部に沿って局在し、中心部へと広がります。これらの違いは、ウイルスが肝実質に侵入する経路が異なることで説明されます。A型肝炎ウイルスは門脈から肝臓に侵入し、小葉の中心部まで広がりますが、B型肝炎ウイルスは、すべての小葉に均等に栄養を供給する肝動脈と毛細血管の枝から中心部まで侵入します。
肝実質の損傷の程度は、ほとんどの場合、疾患の臨床症状の重症度に比例します。軽症では通常、肝細胞の局所壊死が観察され、中等症および重症では帯状壊死が認められます(重症では、癒合して橋状の壊死を形成する傾向があります)。
肝実質における最も大きな形態変化は、臨床症状のピーク時に観察され、これは通常、発症後10年目に一致します。20年目、特に30年目には、再生プロセスが活発化します。この時期までに、壊死性変化はほぼ完全に消失し、細胞浸潤プロセスが優勢になり始め、その後、肝細胞板の構造がゆっくりと回復します。しかし、肝実質の構造と機能が完全に回復するのは、発症後3~6ヶ月後であり、すべての患者に当てはまるわけではありません。
B型肝炎の感染が一般化していることは、肝細胞だけでなく、腎臓、肺、脾臓、膵臓、骨髄細胞などでもHBsAgが検出されることによって確認されます。
胆汁うっ滞性(胆管周囲溶解性)肝炎は、肝内胆管に最も大きな形態変化が見られ、胆管炎および胆管周囲炎の所見を呈する特殊な形態です。胆汁うっ滞型では、胆汁うっ滞に伴って毛細胆管が拡張し、毛細胆汁がうっ滞し、胆管の増殖と周囲の細胞浸潤が見られます。この形態の肝炎では、肝細胞への影響はわずかです。臨床的には、この疾患は長期にわたる黄疸を伴う長期経過を特徴とします。このような特殊な経過の原因は、ウイルスが主に胆管壁に影響を与え、肝細胞への影響はわずかであることが示されている。


