記事の医療専門家
新しい出版物
非常にまれな代謝障害の 1 つであるアルカプトン尿症は、アミノ酸チロシンの代謝における先天異常を指します。
この症候群は、ホモゲンチジン酸酸化酵素欠損症、ホモゲンチジン尿症、遺伝性オクロノーシス、黒色尿症とも呼ばれることがあります。[ 1 ]
疫学
統計によると、アルカプトン尿症の症例は100万人あたり9件以下です。また、ほとんどのヨーロッパ諸国では、出生児10万~25万人あたり1件の症例があります。
ヨーロッパ諸国の中では、スロバキア(特に比較的小規模な北西部)が例外で、アルカプトン尿症の有病率は新生児19,000人あたり1人です。これは、同国に住むスロバキア系ロマ人家族において、近親婚(いとこ同士の結婚)の割合がヨーロッパで最も高く、10~14%であることが原因であると考えられます。[ 2 ]
原因 アルカプトン尿症
アルカプトン尿症は、芳香族(同素環式)α-アミノ酸チロシンの異化(代謝分解)の先天性疾患であり、その正確な原因は解明されています。このタイプの代謝障害は、3番染色体上の数千の遺伝子の1つ、より正確には染色体長腕の3q21-q23座に位置するHGD遺伝子のホモ接合性または複合ヘテロ接合性変異の結果です。この遺伝子は、肝臓酵素ホモゲンチジン酸-1,2-ジオキシゲナーゼ[ 3 ](ホモゲンチジン酸オキシダーゼまたはホモゲンチジン酸オキシダーゼとも呼ばれる)のヌクレオチド配列をコードしています。これは、体内のチロシン分解の段階の1つに必要な鉄含有金属タンパク質です。[ 4 ]、[ 5 ]
したがって、アルカプトン尿症は、ホモゲンチシン-1,2-ジオキシゲナーゼという酵素の欠陥であり、より正確には、遺伝的に決定される欠乏または完全な欠如の結果です。[ 6 ]
アルカプトン尿症は先天性の酵素欠乏症であり、常染色体劣性形質として遺伝します。つまり、子供にアルカプトン尿症が発生するには、両親が酵素の改変された遺伝子を持っている必要があります。両親はそれぞれ、2つある遺伝子のうち1つのコピーだけを子供に渡すからです。
最新のデータによれば、HGD遺伝子の変異は200種類以上存在し、ミスセンス変異、転座、スプライシングが最も多く観察されています。
危険因子
この先天性酵素症を発症する唯一の危険因子は、家族歴があることと、HGD遺伝子の改変された2つのコピーを受け継いでいることであり、両親がアルカプトン尿症を示さない場合(異常の遺伝リスクは25%)、または両親のどちらかがこの疾患に罹患している場合である。[ 7 ]
病因
チロシンは、タンパク質の合成、色素タンパク質(皮膚色素のメラニン)、甲状腺ホルモン、カテコールアミン神経伝達物質の生成に重要な役割を果たします。
細胞内のチロシン量を調節するメカニズムは非常に複雑で、体は過剰なチロシン量を分解することで正常化します。チロシンの分解プロセスは、他の芳香族アミノ酸と同様に、多段階的であり、複数の段階を経て進行します。チロシンの代謝分解の各段階は、特定の酵素の関与と中間化合物の形成を伴って進行します。
まずアミノ酸はパラヒドロキシフェニルピルビン酸に分解され、これがアルカプトン(2,5-ジヒドロキシフェニル酢酸、またはホモゲンチジン酸)に変換されます。その後、アルカプトンはマレイン酢酸に変換されるはずですが、実際にはそうはなりません。[ 8 ]
アルカプトン尿症の病因は、ホモゲンチジン酸の形成段階でのチロシン分解の生化学反応の停止にあります。つまり、それを分解するために必要な酵素、つまりホモゲンチジン酸酸化酵素が存在しないのです。
ホモゲンチシン酸は体内で利用されず、腎臓からの排泄によって蓄積される可能性があります。さらに、ホモゲンチシン酸は酸化されてベンゾキノ酢酸(ベンゾキノン酢酸)となり、組織や体液の分子と結合してメラニンのような色のバイオポリマー化合物を形成します。
組織内のこれらの中間生成物の蓄積により、軟骨組織のコラーゲン構造が破壊され、弾力性が低下します。その結果、アルカプトン尿症の多くの臨床症状が現れ、合併症が発生します。
症状 アルカプトン尿症
新生児および乳児におけるアルカプトン尿症は、尿の黒ずみを特徴とする。空気に触れると、おむつ、おむつカバー、下着に付着した尿は暗褐色になる。これは、ホモゲンチジン酸が蓄積・放出され、それが酸化されてベンゾキノ酢酸となるためである。[ 9 ]
他の症状がない場合、幼児のアルカプトン尿症は、排尿後数時間で尿が黒ずむため、早期に発見されないことがよくあります。あるデータによると、この酵素欠損症を持って生まれた12ヶ月未満の乳児のうち、臨床現場で特定されるのはわずか5分の1です。そのため、親は乳児のケアに細心の注意を払うことが非常に重要です。
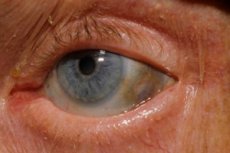
さらに、初期症状には眼の強膜や耳や鼻の軟骨の色素沈着(青灰色)があり、これはしばしばオクロノーシスと呼ばれます。[ 10 ]
時間が経つと、他の症状も現れます。
- 頬骨、脇の下、性器の皮膚の重度の色素沈着。
- 体の汗をかいた部分に触れると衣服が汚れる。
- 全身の衰弱の発作;
- かすれた声。
上で述べたように、アルカプトン尿症とオクロノーシスは、チロシン異化障害の同義語であることに留意する必要があります。
メープルシロップ尿症とアルカプトン尿症。先天性メープルシロップ尿症、またはロイシン症も代謝障害であり、遺伝様式は同じで、同じ染色体上で変異が発生することもありますが、分岐鎖α-ケト酸脱水素酵素複合体をコードする遺伝子に影響を及ぼします。このため、体はタンパク質の特定の成分、特にロイシン、イソロイシン、バリンといったアミノ酸を分解できません。この疾患では、尿(および耳垢)に甘い匂いがします。さらに、このタイプの有機酸血症の臨床像には、色素沈着低下、血圧の変動、発作、嘔吐、下痢、血糖値の低下、ケトアシドーシス、幻覚などがあります。小児の死亡率は非常に高く、成人では治療を行わない場合、脳浮腫により昏睡や死亡に至る可能性があります。
白皮症とアルカプトン尿症は、チロシンによってのみ「結合」しています。眼皮膚白皮症を含む白皮症は、メラニン色素の生成に影響を与える遺伝子変異によって引き起こされます。先天性変化は、11番染色体(11q14.3)のTYR遺伝子に認められます。この遺伝子は、チロシン代謝産物に基づく皮膚色素の形成に必要な銅含有メラノソーム酵素であるチロシナーゼをコードしています。この疾患はアルカプトン尿症よりもはるかに多く見られます。
合併症とその結果
アルカプトン尿症はチロシンの中間代謝産物であるホモゲンチジン酸およびベンゾキノン酢酸の作用によって引き起こされ、反応性色素ポリマーの沈着、コラーゲン原線維の破壊、軟骨の状態の悪化(機械的ストレスに対する耐性の低下)により、その影響と合併症が現れます。
成人期には長年にわたり、大関節(股関節、仙腸関節、膝関節)の変形性関節症や変性関節症を発症し、椎間腔が狭まり(特に腰椎と胸椎)、石灰化や骨棘形成を伴います。軟骨下骨板の組織密度が低下し、その下の骨は病的なリモデリングを起こし、腫瘍や変形が生じることがあります。[ 11 ]
同じ石灰化により、心臓弁(大動脈弁と僧帽弁)や冠動脈の損傷(冠動脈疾患の兆候を伴う)や、腎臓や前立腺の結石形成が観察される場合がある。[ 12 ]、[ 13 ]
診断 アルカプトン尿症
通常、先天性代謝障害の診断は、体液の検査に基づいて行われます。
アルカプトン尿症はどのような検査と反応に基づいて診断できますか?尿検査ではホモゲンチジン酸の検出とその濃度(正常範囲:1日20~30 mg、高値範囲:3~8 g)を測定する必要があります。尿サンプルはガスクロマトグラフィーまたは質量分析法、液体クロマトグラフィーを用いて検査されます。尿中の塩化鉄の存在をスクリーニング検査することも可能です。[ 14 ]
迅速な診断方法として、紙の上の乾燥した尿の染みに含まれるアルカプトンを(色の濃さで)判定する方法もあります。
診断を明確にする際には、機器診断(放射線検査)によって患者の変形性関節症やその他の関節病変の放射線学的徴候を特定する必要があります。
診断は遺伝子検査やDNA配列決定など遺伝性疾患を診断する分子遺伝学的方法によって確認される。[ 15 ]
差動診断
鑑別診断には、新生児ヘモクロマトーシスおよび急性肝不全、メラニン尿症、急性間欠性ポルフィリン症、血球貪食性リンパ組織球症、原発性ミトコンドリア病変、関節リウマチ、強直性脊椎炎などがあります。
連絡先
処理 アルカプトン尿症
アルカプトン尿症の主な治療は、アスコルビン酸の大量(1日1000mg以上)の経口投与です。小児では尿中へのホモゲンチジン酸の排泄量が増加し、成人ではその誘導体であるベンゾキノン酢酸の尿中含有量が減少し、関節やコラーゲンの結合組織構造への結合が遅くなります。[ 16 ]
西ヨーロッパの医療機関では、チロシン分解の第二段階、すなわちパラヒドロキシフェニルピルビン酸からホモゲンチジン酸への変換を阻害する代謝産物群に属する薬剤、ニチシノン(オルファリン)の試験が行われています。しかし、この薬剤の使用はチロシンの蓄積を招き、角膜混濁や羞明、鼻血や胃出血、肝不全、血液の変化など、重篤な副作用を引き起こす可能性があります。しかしながら、米国では、ニチシノンはI型チロシン血症の治療薬としてFDAの承認を受けています。[17 ]、[ 18 ]
そのため、アルカプトン尿症によって引き起こされる関節の問題に対しては、筋力を高め関節可動域を広げる運動療法、痛みを抑える温泉療法、骨盤療法などの理学療法治療が行われます。
チロシンは食物から供給されるだけでなく、体内でも生成されますが、アルカプトン尿症の患者は、低タンパク質食を摂り、チロシンを豊富に含む食品(主に牛肉、豚肉、乳製品(特にチーズ)、豆類、ナッツ類、種子類)の摂取を制限することが推奨されます。
防止
遺伝子変異の予防は不可能ですが、先天性疾患のリスクが高い子どもの誕生を防ぐために、遺伝性疾患の家族歴があるカップルが妊娠を計画する前に受ける必要がある医療遺伝カウンセリングがあります。[ 19 ]
予測
アルカプトン尿症による致死的な転帰は非常に稀ですが、心臓や腎臓に重篤な合併症が起こり、死に至ることもあります。そのため、アルカプトン尿症の患者の平均余命は良好です。
しかし、関節や脊椎の激しい痛みと、進行性にともなう著しい運動制限により、生活の質は低下します。


