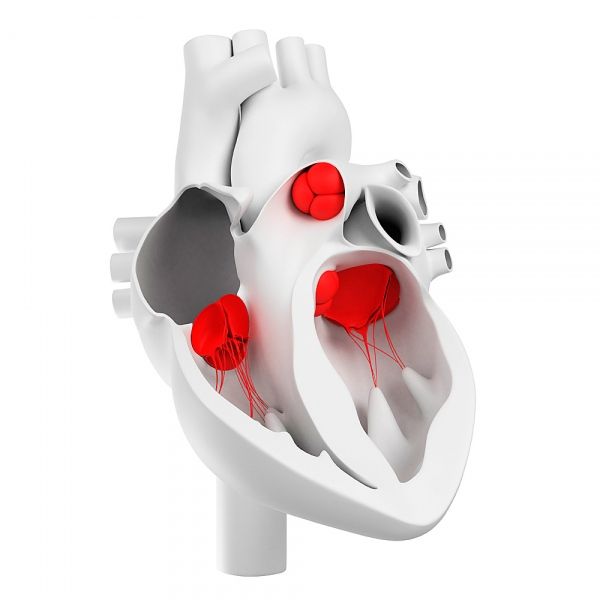
心臓弁
最後に見直したもの: 23.04.2024
以前は、すべての心臓弁は単方向の血流への寄与が単に作用する圧力勾配に応答する受動的な運動である単純な構造であると考えられていた。この「受動的構造」の理解は、「受動的」な機械的および生物学的弁代替物の創出につながった。
心臓弁がより複雑な構造および機能を有することは、今や明らかになる。従って、「能動的な」心臓弁代替物の作成は、組織工学の発展のために長期的には実現可能な天然の心臓弁とのその構造および機能に著しい類似性を示唆している。
心臓弁は、心内膜の挿入中に間葉組織の胚芽から発達する。形態形成の過程において、房室(三尖弁および僧帽弁)および心室流出管(大動脈および肺心臓弁)が形成される。
心臓弁はどのように配置されていますか
弁への血液供給の研究の開始は、質量が対照的な心臓血管の注入を用いて、Luschka(1852)によってなされた。彼は大動脈と肺動脈の房室弁と半月弁の弁に多数の血管を発見した。様々な病因と心内膜炎の動脈硬化 - しかし、病理学的解剖学、組織学上のガイドの数に変更されていない人間の心臓弁が唯一の様々な病理学的プロセスにおけるバルブに登場する任意の血管、後者が含まれていない兆候がありました。血管の欠如に関する情報は、主に組織学的研究に基づくものであった。弁の自由部分に血管がない場合、弁を掃除する血漿から流体を濾過することによって栄養が生じると仮定した。線条筋肉組織の繊維と共にいくつかの血管が弁および腱索の基部に浸透したことが示された。
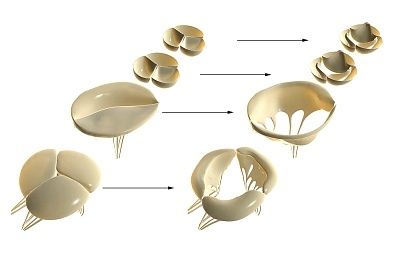
しかし、心臓の異なる色素の注入容器は(ゼラチン、ビスマスゼラチン水性スラリーブラックマスカラでカーカスは、カルミン又はトリパンブルーの溶液)は、それが血管が心筋組織と共に房室cerdechnye弁、大動脈及び肺動脈を貫通していることが判明した場合葉の自由端にわずかに達していない。
房室弁の弁の脆弱な線維性結合組織において、別個の主血管が見出され、血管には心臓の横方向の筋組織の多数の配置された領域が吻合された。
血管の最大数は、ベースに位置し、これらのバルブの自由な部分では比較的少ない。
KI Kulchitskyら(1990)によれば、動脈および静脈のより大きな直径の血管が僧帽弁に見られる。この弁の弁の基部には、弁の基部に貫入し、その領域の10%を占める毛細血管の狭いループの網目構造を主に有する主血管がある。三尖弁では、動脈血管の直径は僧帽弁よりも小さい。この弁の弁には、主に散在したタイプの血管および血液毛細血管の比較的広いループがある。僧帽弁において、前葉は、三尖弁、前弁および後弁に流れる血液の方が集中的であり、主閉鎖機能を担う。成人の心臓の房室弁における動脈および静脈血管の直径の比は1:1.5である。毛管ループは多角形であり、弁フラップの基部に対して垂直に配置される。血管は、心房の側部から内皮の下に位置する平面ネットワークを形成する。また、腱索には血管も見られ、右心室および左心室の乳頭筋から腱索の長さの30%までの距離まで浸透する。多数の血管が腱索の基部にアーチ状のループを形成する。大動脈および肺動脈の心臓弁は、房室とは有意に異なる。比較的小さい直径の主血管は、大動脈弁および肺動脈弁の半月弁の基部に適合する。これらの血管の短い枝は、不規則な楕円形および多角形の毛細管ループで終結する。彼らは、主に、半月翼の底近くに位置しています。大動脈および肺動脈の弁の基部の静脈血管もまた、房室弁の基部よりも小さい直径を有する。成人の心臓の大動脈および肺動脈弁の動脈および静脈の直径の比は1:1.4である。より大きな血管からは、短い側枝が分岐し、間違った楕円形と多角形の毛細血管で終わる。

年齢とともに、コラーゲンやエラスチン、ならびに緩い繊維の不規則な結合組織の数を減らすなどの結合組織繊維の粗大化があることフラップ組織が房室弁と大動脈と肺動脈の半月弁のリーフレットを硬化症発症します。縮小長繊維心臓横紋筋バルブしたがってその量を減少させ、心臓に侵入するの数は血管弁。これらの変化に関連して、心臓弁は弾性及び弾性特性を失い、これは弁閉鎖及び血行動態に影響を及ぼす。
心臓弁は、リンパ管状の毛細血管網と弁を備えた少数のリンパ管を有する。弁のリンパ管は特徴的な外観を有し、管腔は非常に不規則であり、異なる領域の同じ毛細管は異なる直径を有する。いくつかのキャピラリーの接合部には、様々な形状の延長部が形成されています。ネットワークループは、多くの場合、不規則な多角形であり、楕円形または丸形ではありません。多くの場合、リンパ管ループは閉鎖されず、リンパ管は盲目的に終わる。リンパ管ループは、弁の自由端から基部に向かう方向により多く配向される。多くの場合、房室弁の弁に2層のリンパ管状網状組織が認められた。
心内膜の神経叢は、主に内皮下の様々な層に位置する。弁フラップの自由端において、神経線維は、主に放射状に、腱索のものに接続されている。弁の基部の近くには、輪状リングの周りの叢に接続する大型叢神経叢がある。半楕円弁では、心内膜神経回路網はより稀である。弁を取り付ける場所では、それは厚くなり、多層になる。
心臓弁の細胞構造
バルブ構造の維持に関与するバルブ間質細胞は、バルブマトリックス全体にわたって広がる多数の薄いプロセスを有する細長い形状を有する。弁間質細胞の2つの集団があり、形態および構造が異なる。いくつかは収縮特性を有し、収縮原線維の存在を特徴とし、他は分泌特性を有し、十分に発達した小胞体およびゴルジ体を有する。収縮機能は血行力学的な圧力に抵抗し、アルファおよびベータミオシンの重鎖およびトロポニンの種々のアイソフォームを含む心臓および骨格の収縮性タンパク質の両方の産生によってさらに支持される。心臓弁の弁の収縮は、弁の正常な機能のための生物学的刺激の協調作用を示唆する多数の血管作用薬に応答して実証された。
間質細胞は、心臓弁のような構造の還元系の必須成分でもある。弁の一定の動きおよびそれに付随する結合組織の変形は、弁の間質細胞が反応して弁の完全性を維持する損傷を生じる。回復プロセスは、弁の正常な機能にとって不可欠であり、人工弁の現代のモデルにおけるこれらの細胞の不在はおそらく、生体人工器官の構造的損傷に寄与する因子である。
間質細胞の研究における重要な方向は、分子の焦点接着によって媒介される、それらと周囲のマトリックスとの間の相互作用の研究である。焦点接着は、細胞の細胞骨格とインテグリンを介してマトリックスタンパク質とを結合させる特殊な細胞 - マトリックス相互作用である。それらはまた、細胞接着、移動、成長および分化を含むがこれらに限定されない応答を誘発することができる、細胞外マトリックスからの機械的情報を伝達する、形質導入のためのシグナル伝達部位として作用する。弁膜間質細胞の細胞生物学を理解することは、これらの細胞がお互いおよび環境と相互作用するメカニズムを確立する上で不可欠であり、この機能は人工弁で再現することができる。
細胞interstitsiapnyh組織工学心臓弁研究の有望な分野の発展に関連しての多種多様な技術を用いて行われています。ビメンチン、デスミン、トロポニン、α-アクチンおよびミオシン、平滑筋重鎖α-およびβ-ミオシン軽鎖-2心筋ミオシン、α-およびβ-チューブリンについて染色細胞の細胞骨格を検証しました。収縮性細胞epinefrinする肯定応答、アンギオテンシンII、ブラジキニン、カルバコール、塩化カリウムを確認し、内皮細胞I.関数関係を決定し、検証がkarboksiflyuorestseinaマイクロインジェクションの相互作用をスロット。マトリックス分泌はプロリル-4-ヒドロキシラーゼ/ II型コラーゲン、フィブロネクチン、コンドロイチン硫酸、ラミニンのための染色をインストールしました。神経支配は、遺伝子関連ペプチドkaptsitonin、神経ペプチドYチロシンヒドロキシラーゼ、アセチルコリン、血管作動性腸管ポリペプチド、サブスタンスPの活性に影響を与える近接運動神経終末を、インストールされています。分裂促進因子は、継承された血小板増殖因子、塩基性線維芽細胞増殖因子、セロトニン(5-HT)を評価しました。線維芽細胞は、間質細胞は、不完全な基底膜、マトリックス、よく発達した粗面小胞体およびゴルジ装置、マイクロフィラメントの富、接着結合の形成に密接長く、細い細胞質プロセスによって特徴付けられる研究しました。
弁膜内膜細胞は、血管内皮と同様に、各心臓弁の周りに機能的な細胞外エンベロープを形成する。広く使用されている弁交換の方法は、人工弁に血小板およびフィブリンの沈着、細菌感染および組織石灰化の発生をもたらし得る心内膜の保護機能を排除する。これらの細胞の別の可能性のある機能は、内皮による平滑筋細胞の調節と同様に、下層の間質細胞の調節である。複雑な相互作用は、内皮細胞によって分泌される可溶性因子によって部分的に媒介される内皮細胞と隣接細胞との間に存在する。これらの細胞は巨大な表面を形成し、内腔側の微小増殖で覆われ、循環血液の代謝物質との曝露および可能性のある相互作用を増加させる。
内皮細胞は、しばしば、血液の動きの間に生じる血管壁での剪断応力によって引き起こされる形態学的および機能的な違いが表示され、同じことが細長い多角形の両方を受信弁心内膜細胞に適用されます。細胞の構造の変化は、細胞の細胞骨格の成分に対する局所的血行動態の作用またはその下にある細胞外マトリックスの変化によって引き起こされる二次的効果のために起こり得る。超音波心臓弁のレベルでは、心内膜細胞は細胞間結合、血漿小胞、不均一な小胞体およびゴルジ体を有する。彼らは、in vivoおよび人工的な環境の両方で、フォンヴィレブランド因子を産生するという事実にもかかわらず、彼らは子牛ヴァイベル-パラーデ血管内皮に特有の細胞小器官です(フォン・ヴィレブランド因子が含まれている特定の顆粒)を欠きます。弁膜内膜細胞は、強い関節、機能的なギャップの相互作用、および周縁の折り畳みによって重なり合って特徴付けられる。
心内膜細胞もインビトロでそれらの代謝活性を保持する:生成ビルブラント因子、プロスタサイクリン、アンギオテンシン変換酵素の一酸化窒素合成酵素の活性を示すが、強く、単離された接着性は、免疫応答の発達に単核細胞の結合のために重要であるICAM-1、ELAM-1分子。これらのマーカーの全ては、組織工学によって人工の弁を作成するための理想的な細胞培養の栽培に含まれるべきであるが、バルブ心内膜細胞の免疫刺激性自体は、その使用を制限することができます。
細胞外メトリックス心臓弁は、繊維状コラーゲンおよびプロテオグリカンおよび糖タンパク質のエラスチン高分子から成ります。バルブ、エラスチンの乾燥重量の60% - - 10%およびプロテオグリカン - 20%のコラーゲンです。コラーゲン成分は、弁の基本的な機械的安定性を提供し、コラーゲンI(74%)によって表される。II型(24%)およびV型(2%)である。コラーゲンフィラメントの束は、それらの間で相互作用するエラスチンシースによって取り囲まれている。プロテオグリカン分子のグリコサミノグリカン側鎖が他の分子は、マトリックス配線と他の成分が堆積された永久を形成するように相互作用するゲル状物質を形成する傾向があります。グリコサミノグリカン人間の心臓弁は、より少ない程度に、主にヒアルロン酸からなる - デルマタン硫酸、コンドロイチン-4-硫酸およびコンドロイチン-6-硫酸、ヘパラン硫酸の最小値と。マトリックス組織の再構築および更新は、マトリックスメタロプロテイナーゼ(MMP)およびそれらの組織阻害剤(TI)によって調節されます。これらの分子はまた、生理学的および病理学的プロセスの広い範囲で、間質コラゲナーゼ(MMP-1、MMP-13)、ゼラチナーゼ(MMP-2、MMP-9)およびそれらの組織阻害剤(TI-1、五含むいくつかのメタロプロテイナーゼが、関与しています2、TI-3)は、心臓の全ての弁に見られる。メタロプロテイナーゼ産生の過剰は、心臓弁の病的状態にとって典型的である。
 [6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16]
[6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16]
心臓弁およびその形態学的構造
心臓弁は、弁のマトリックスの3つの形態学的に異なる、機能的に重要な層(繊維質、海綿質および心室)からなる。
繊維層は、コラーゲン繊維の層からなるバルブフラップの耐荷重フレームを形成する。これらの繊維は、閉鎖時に動脈弁を引き伸ばす可能性のために、折り畳みの形態で半径方向に配置される。繊維層は、これらの弁の出口外面の近くに位置する。房室弁の繊維層は、腱索のコラーゲンビームの連続として機能する。スポンジ(入口)層と心室(出口)層の間に位置する。
線維性と心室性の間に海綿質の層(海綿質)がある。海綿質層は、粘性媒体中の結合組織が不十分に組織化されている。この層の支配的なマトリックス成分は、任意に配向したコラーゲンおよびエラスチンの薄い層を有するプロテオグリカンである。プロテオグリカンの分子の側鎖は強い負電荷を有し、これは水と結合してマトリックスの多孔質ゲルを形成する高い能力に影響する。海綿質マトリックス層は、心臓弁の弁における機械的応力を低減し、柔軟性を維持する。
心室層は他よりもはるかに薄く、組織が一定の変形に耐えることを可能にする弾性繊維が豊富である。エラスチンは、コラーゲン繊維を包囲して連結するスポンジ状の構造を有し、中立の折り畳み状態での維持を保証する。弁の入口層(動脈弁のための心室および房室弁のための海綿質)は、弁を閉じるときに水圧の衝撃を軟化させる出口よりも多量のエラスチンを含む。コラーゲンとエラスチンとのこの関係は、永久変形なしにバルブを40%まで拡張することを可能にする。小さな荷重の影響下で、この層のコラーゲン構造は荷重方向に配向され、荷重のさらなる成長に対する抵抗力が増大する。
このように、心臓内弁の複製としての心臓弁の概念は、単純化されているだけでなく、実際には誤っている。心臓弁は、線条筋線維、血液およびリンパ管、および神経要素を含む複雑な構造を有する臓器である。それらの構造と機能の両方において、弁は心臓の全ての構造を有する単一の全体を形成する。弁の正常機能の分析は、その細胞組織化、ならびにそれら自身とマトリックスとの間の細胞の相互作用を考慮に入れなければならない。このような研究から得られた知見は、組織工学を用いた弁置換術の設計および開発をリードしている。


