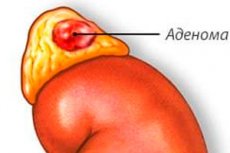
副腎腺腫は、腎臓の上に位置する対の臓器である副腎で発生する良性腫瘍です。
腎臓の上にある副腎はホルモンを生成します。それらは、髄質組織と皮質組織の両方で構成されています。副腎質量の約 15% を占める副腎髄質組織は、ストレスに対する交感神経反応の一部としてカテコールアミンを生成および放出することにより、ストレスの多い状況下で循環するドーパミンに反応します。 [1]副腎皮質は、髄質帯、束帯、網状帯として知られる異なる領域に分けることができます。各ゾーンは、特定のホルモン、つまりミネラルコルチコイド、糖質コルチコイド、アンドロゲンの生成を担当します。
アンドロゲン産生腺腫は非常にまれであり、副腎皮質癌と合併することがより一般的です。 [2]、 [3]コルチゾールの過剰産生は、ホルモンの産生量とそれに伴う症状によって分類できます。全身症状を伴うコルチゾールを産生する腺腫は、クッシング症候群の典型的な症状と考えられています。一方、コルチゾール過剰症の明白な兆候がなく、コルチゾールの産生量が少ない腺腫は、軽度自律コルチゾール分泌腫瘍 (MACS) と呼ばれます。
ここでは、原因、症状、診断、治療、予後について個別に詳しく説明します。
理由:
- 副腎腺腫の原因はさまざまですが、正確な原因は不明なことが多くあります。場合によっては、副腎腺腫は遺伝子変異または遺伝的要因に関連している可能性があります。
- 場合によっては、副腎腺腫が機能的である可能性があり、過剰なホルモンを産生し、関連する症状や疾患の発症につながる可能性があることに注意することが重要です。
症状:
- 副腎腺腫の症状は、副腎腺腫が産生するホルモンの種類と過剰なホルモンの量によって異なります。たとえば、症状としては、高血圧 (高血圧)、過剰体重、筋力低下、骨量の減少 (骨粗鬆症)、女性の月経不順、顔毛や体毛の増加 (多毛症) などが挙げられます。
診断:
- 副腎腺腫の診断には、コンピューター断層撮影 (CT) スキャン、磁気共鳴画像法 (MRI)、ホルモンレベルを測定する血液検査などのさまざまな方法が含まれます。
- 正確な診断により、腫瘍の種類とその機能活性が決定されます。
処理:
- 副腎腺腫の治療には、特に腫瘍が大きい場合、機能性がある場合、または重度の症状を引き起こす場合、腫瘍の外科的除去(腺腫切除術)が含まれる場合があります。手術は腹腔鏡技術を使用して実行される場合があり、通常、これにより回復期間が短縮されます。
- 場合によっては、腫瘍が機能しておらず、重大な脅威をもたらさない場合、医師は単に経過観察を行うことを決定することがあります。
予測:
- 予後は、腫瘍の大きさと種類、症状の有無、手術の成功率、その他の要因を含む多くの要因によって決まります。ほとんどの場合、副腎腺腫が早期に検出され、切除に成功した場合、予後は通常良好です。
- ただし、治療後の状態を監視し、再発やその他の問題がないか定期的に医師の診察を受けることが重要です。
疫学
コンピューター断層撮影 (CT) の使用の増加により、報告されている副腎腺腫の発生率が増加しています。報告されている副腎偶発腫の有病率は、使用される基準によって異なります。 CTスキャンに基づいて、副腎偶発腫の有病率は0.35%から1.9%の範囲であると研究が報告しています。しかし、一連の解剖では有病率が2.3%と若干高いことが示された。 [4]
副腎腺腫は、副腎偶発腫の約 54% ~ 75% を占めます。 [5]ほとんどの研究は、男性よりも女性の方が副腎腺腫の有病率が高いことを示していますが、 [6]、 [7]特に韓国の大規模な研究では、男性が優勢な症例がいくつかあります。 [8]診断の平均年齢は 57 歳で、報告された症例は 16 歳から 83 歳までの幅広い年齢層に及びます。
副腎偶発腫の症例の約 15% にホルモンの過剰分泌が見られます。報告されている有病率は、皮質過剰症が 1% ~ 29%、アルドステロン過剰症が 1.5% ~ 3.3%、褐色細胞腫が 1.5% ~ 11% です。 [9]
原因 副腎腺腫
副腎腺腫の原因はさまざまで、次のようなものがあります。
- 遺伝的素因: 特定の遺伝子変異は、ホルモン活性のある副腎腺腫とホルモン不活性な副腎腺腫の両方に関連しています。しかし、それらの発症の根底にある正確なメカニズムは依然として不明です。 [10]副腎腺腫の一部の症例は、遺伝的遺伝子変異の存在またはこの疾患の家族歴に関連している可能性があります。たとえば、メンデルソン症候群などの遺伝性副腎過形成症候群は、腺腫の発症リスクを高める可能性があります。 [11]
β-カテニン生成 (Wnt/β-カテニン経路) の指示を与える CTNNB1 遺伝子の変異は、副腎皮質のより大きな非分泌腺腫の発生に関連しています。 [12]
コルチゾール産生大結節性副腎結節に関連する変異には、PRKACA (コルチゾール産生腺腫に関連)、 [13]、 [14]GNAS1 (マッキューン・オルブライト症候群に関連)、 [15]MENIN (多発性内分泌腫瘍症 1 型に関連)。 、ARMC5(原発性両側大結節性副腎過形成に関連)、APC(原発性両側大結節性副腎過形成に関連)、およびFH(原発性両側大結節性副腎過形成に関連)。 [16]コルチゾールを産生する微小結節性副腎過形成は、PRKAR1A (カーニー複合体変化による原発性副腎色素結節性疾患に関連)、PDE11A (孤立性微小結節性副腎疾患に関連)、および PDE8B (孤立性微小結節性副腎疾患にも関連) に起因します。 [17]
アルドステロン産生副腎腺腫に関連する変異には KCNJ5 が含まれ、このような症例の約 40% を占めます。 [18]さらに、ATP1A1、ATP2B3、CACNA1D、CTNNB1 の変異もこの疾患に関連しています。 [19]
- ランダム変異:まれに、副腎細胞のランダム変異により副腎腺腫が発生することがあります。
- ホルモン分泌の増加:副腎による特定のホルモンの産生の増加は、腺腫の発生に寄与する可能性があります。たとえば、副腎はコルチゾール、アルドステロン、アドレナリンなどのホルモンを生成し、これらのホルモンの放出増加により腫瘍発生の準備が整えられる可能性があります。
- ホルモン剤の管理されない使用: グルココルチコステロイドなどの特定のホルモン剤を長期かつ管理されずに使用すると、副腎腺腫のリスクが高まる可能性があります。
- 特発性腺腫:場合によっては、腺腫発生の原因は不明であり、「特発性」と呼ばれます。
症状 副腎腺腫
副腎腺腫の症状は、そのサイズ、機能活性、その他の要因によって異なります。考えられる症状の一部を次に示します。
- 高血圧(高血圧):アルドステロンやカテコールアミンなどのホルモンの過剰放出により、副腎腺腫は高血圧を引き起こす可能性があります。
- 体重増加:一部の腫瘍は過剰な体液の蓄積と体重増加を引き起こす可能性があります。
- 皮膚の色素沈着過剰:副腎による ACTH (副腎皮質刺激ホルモン) の過剰産生により、皮膚の色素沈着が、特に体の粘膜や線のある部分に発生することがあります。
- グルコースと代謝障害:副腎によるホルモンの過剰産生は代謝に影響を与え、グルコース抵抗性やインスリン抵抗性を引き起こす可能性があります。
- ホルモン障害:症状には、イチェンコ・クッシング症候群を引き起こす可能性があるコルチゾール(コルチコステロイド)や、女性の高アンドロゲン症に関連する症状を引き起こす可能性があるアンドロゲン(男性ホルモン)などのホルモンレベルが含まれる場合があります。
- 腹部または背中の痛み:場合によっては、副腎腺腫が腹部または背中の領域に不快感や痛みを引き起こすことがあります。
合併症とその結果
コルチゾール産生副腎腺腫に起因するクッシング症候群は幅広い合併症を伴いますが、その中でも代謝障害と心血管障害が特に注目に値します。 [20]副作用は主に、皮質機能亢進によって引き起こされるインスリン抵抗性の増加のメカニズムに起因し、その後の腹部肥満の増加につながります。 [21]過去数年にわたり、MACS を伴う副腎腺腫でもこれらの合併症が報告されています。 [22]、 [23]さらに、コルチゾールの過剰産生は視床下部-下垂体-甲状腺軸を抑制し、T3/T4 ホルモンレベルを低下させるソマトスタチンを刺激します。 [24]同じ作用機序が、これらの患者における成長ホルモン産生の低下にも関与しています。 [25]
アルドステロン産生腺腫に関連する最も一般的な合併症は、制御されていない動脈性高血圧です。適切な診断と治療がなければ、原発性アルドステロン症はネフロンレベルでのナトリウムと水分の貯留を引き起こし、体液過剰、心不全、心房細動、心筋梗塞などの合併症を引き起こす可能性があります。 [26]
まれに、機能していない副腎腺腫が集団影響を引き起こす可能性があります。ただし、集団影響を引き起こすほど大きな病変のほとんどは悪性であることに注意することが重要です。
診断 副腎腺腫
副腎腺腫の診断には、腫瘍の存在を検出し、そのサイズ、性質、位置を決定するのに役立つさまざまな方法と検査が含まれます。副腎腺腫を診断するための主な方法のいくつかを以下に示します。
- 臨床検査と病歴聴取: 医師は患者の一般的な検査を行い、高血圧 (高血圧)、色素沈着過剰 (皮膚の色素沈着の増加)、過剰な体毛など、副腎腺腫に関連する可能性のある症状について質問します。
- 血液検査:
- コルチゾール、アルドステロン、デヒドロエピアンドロステロン(DHEA)などの副腎ホルモンレベルの測定。
- 血液中の副腎皮質刺激ホルモン (ACTH) レベルの測定。
- 免疫診断: 尿および/または血液中の 17-ヒドロキシプロゲステロン濃度の測定。これは、一部の形態の副腎腺腫で上昇する可能性があります。
- 教育方法:
- 腫瘍の画像化および腫瘍の特徴付けのための腹部および副腎のコンピューター断層撮影 (CT) および/または磁気共鳴画像法 (MRI)。
- 腹部と副腎の超音波検査。
- 生検:副腎腺腫の性質(悪性か良性かなど)を判断するために、副腎腺腫の生検が必要になる場合があります。生検は、皮膚への穿刺または腹腔鏡検査によって行われます。
- 機能検査:場合によっては、腫瘍が体内のホルモンレベルにどのような影響を与えているかを判断するために、副腎ホルモン分泌検査などの特別な検査が実行されることがあります。
副腎腫瘍の評価は主に 2 つの重要な目標に焦点を当てています。1 つ目の目標は良性腫瘤と悪性腫瘤を区別することであり、2 つ目の目標は腫瘍がホルモン的に活性であるか機能していないかを判断することです。 [27]
副腎腫瘤が検出されたら、副腎腺腫の評価には CT または磁気共鳴画像法 (MRI) が好ましい画像診断手段となります。 [28]4.0 cm を超える副腎腫瘍は、副腎癌の感受性が高くなります。 [29]さらに、非造影 CT でハウンズフィールド単位 (HU) が 10 未満を示す副腎病変は、良性腺腫を強く示唆します。 [30]一部の良性腺腫では、値が 10 HU を超える場合があります。このような場合、遅延造影CTは良性病変と悪性病変を区別するのに役立つ可能性があります。 [31]、 [32]
遅延 CT 画像での 60% 以上の絶対コントラスト ウォッシュアウトと 40% 以上の相対ウォッシュアウトは、癌腫、褐色細胞腫、または転移のある患者と比較して、腺腫のある患者の診断において感度が高く、特異的であることが報告されています。 [33]、 [34]しかし、最近の研究では、造影剤ウォッシュアウトは良性腺腫を正確に認識するための感度と特異度が低いことが示されました。 [35]MRI は、CT の代替として副腎腫瘍の評価に使用できます。化学シフトイメージングを備えた MRI は、副腎腺腫の診断において高い感度と特異性を示しています。
差動診断
副腎腺腫の鑑別診断には、副腎腺腫の症状を模倣する可能性のある他の疾患や状態からこの状態を特定し区別することが含まれます。副腎腺腫には機能性 (過剰なホルモンを産生する) と非機能性 (過剰なホルモンを産生しない) があり、それが鑑別診断プロセスにも影響することを考慮することが重要です。副腎腺腫の鑑別診断に含まれる可能性のある診断と検査のいくつかを以下に示します。
- グルココルチコステロイド:高コルチゾールレベルは、副腎腺腫またはイチェンコ・クッシング症候群に関連している可能性があります。鑑別診断のために、アジソン症候群(副腎皮質の病変)、内因性うつ病、ステロイド薬などのコルチゾール上昇の他の原因との比較が行われることがあります。
- アルドステロン:アルドステロンの上昇は、副腎腺腫または原発性アルドステロン症(コン症候群)に関連している可能性があります。鑑別診断のために、血中レニンおよびアルドステロンのレベルと特殊な検査が実行される場合があります。
- アドレナリンとノルアドレナリン:過剰量のアドレナリンとノルアドレナリンを産生する副腎腫瘍である褐色細胞腫は、腺腫に似ている可能性があります。尿または血液中のメタンフリンおよびカテコールアミンのプロファイルは、鑑別診断に使用できます。
- 神経内分泌腫瘍: 一部の神経内分泌腫瘍は近くの組織に局在しており、副腎腺腫の症状に似ている場合があります。コンピューター断層撮影 (CT) や磁気共鳴画像法 (MRI) などの研究を使用して、腫瘍を検出し、位置を特定できます。
- 転移: まれに、副腎腺腫は他の臓器からの癌の転移の結果である可能性があります。生検や陽電子放出断層撮影法 (PET-CT) などの検査は、腫瘍の起源を特定するのに役立ちます。
処理 副腎腺腫
ホルモン分泌腺腫の薬物治療は、通常、高齢、重篤な合併症、または外科的矯正を拒否する患者のために手術に適さない患者に予約されています。このような場合、主な目標は症状を軽減し、ホルモン受容体をブロックすることです。グルココルチコイド受容体拮抗薬であるミフェプリストンは、過剰なコルチゾール分泌に使用できます。ケトコナゾールは副腎に直接作用するため、潜在的な選択肢となる可能性があります。 [43]高アルドステロン症の患者は、スピロノラクトンやエプレレノンなどのミネラルコルチコイド受容体拮抗薬で治療する必要があります。
ホルモン不活性腺腫は、最初は 3 ~ 6 か月後に繰り返し画像検査を行い、その後 1 ~ 2 年間は毎年画像検査を行います。さらに、ホルモン評価を 5 年間毎年繰り返し行う必要があります。腫瘤が 1 cm を超える場合、またはホルモンが活性化している場合は、副腎摘出術が推奨されます。 [37]
- 薬物治療:場合によっては、特に手術が不可能な場合、または手術前に、ホルモンレベルを低下させたり、腫瘍のサイズを縮小させるために薬物療法が使用されることがあります。
- 定期的なフォローアップ: 治療が成功した後は、ホルモンレベルを監視し、再発の可能性を監視するために定期的な医学的フォローアップを継続することが重要です。
- 食事とライフスタイル: 場合によっては、食事とライフスタイルの変更が症状を制御し、副腎の健康を維持するのに役立ちます。
術後およびリハビリテーションのケア
外科的矯正の決定は、病気の潜在的な合併症と手術に関連するリスクを考慮して、患者と主治医の間で徹底的に話し合った後に行われます。詳細な検査により腺腫がホルモンを産生していないことが確認された場合、外科的矯正は必要ありません。ただし、ホルモン活性を伴う片側性腺腫では、副腎摘出術が治療のゴールドスタンダードと考えられています。[38]、[ 40]
クッシング症候群およびMACSではコルチゾールが過剰に産生されるため、患者は下垂体-下垂体-副腎(HPA)軸の慢性的な抑制を経験します。副腎摘出術後、患者は HPA 軸の回復中に外因性グルココルチコイドの追加が必要になりますが、これには数か月かかる場合があります。内分泌学会のガイドラインによれば、手術後初日からヒドロコルチゾンの投与を開始し、1日あたり10~12 mg/m 2 の用量から始めて、1日を通して2~3回に分けて投与することが推奨されています。 [39]1日2回のグルココルチコイド投与がグルココルチコイド補充療法の標準的なアプローチですが、最近の研究では、1日3回のグルココルチコイド投与が朝の高コルチゾール血症と夕方の低コルチゾール血症の軽減に役立つ可能性があることが示されています。 [40]患者が 1 日複数回の投与に耐えられない場合、1 日量 3 ~ 5 mg のプレドニゾロンの使用が代替選択肢となります。 [41]ただし、術後グルココルチコイド補充療法後であっても、多くの患者では依然として副腎機能不全の症状が発現する可能性があることに注意する必要があります。
予測
副腎腺腫患者の長期予後は通常良好です。機能していない副腎腺腫は多くの場合、治療を必要としません。過剰なホルモン産生のない副腎の副腎腺腫には、ホルモンが活性化するリスクがあり、1 年以内、2 年以内、5 年以内にそれぞれ 17%、29%、47% と推定されています。 [44]ただし、副腎腺腫から副腎皮質癌への転移は極めてまれです。
副腎腺腫の研究に関連する権威ある書籍と研究のリスト
書籍:
- 「副腎皮質」 (1991) - シュロモ・メルメド著。
- 「クッシング症候群」(2010) - リネット・ニーマン著。
- 「副腎障害」 (2001) - Bruno Allolio と Wiebke Arlt 著。
- 「副腎腫瘍」 (2008) - ヘニング・ドラルとオルロ・H・クラーク著。
研究と論文:
- 「副腎皮質癌:基礎研究と臨床研究の最近の進歩」(2018) - Wengen Chen et al.この論文は「Frontiers in Endocrinology」に掲載されました。
- 「副腎皮質癌の臨床および分子遺伝学」(2020) - Tobias Else et al.この論文は分子細胞内分泌学誌に掲載されました。
- 「クッシング症候群: 病態生理学、診断、および治療」 (2015) - アンドレ・ラクロワ著。この論文は雑誌「Seminars in Nuclear Medicine」に掲載されました。
文学
デドフ、I. I. 内分泌学 : 全国ガイド / 編I. I. デドフ、G. A. メルニチェンコ著。 I.デドフ、G.A.メルニチェンコ。 - 第 2 版モスクワ:GEOTARメディア、2021年。


