軟骨は、血液およびリンパ管の欠如を特徴とする、1つのタイプの細胞(軟骨細胞)のみを含む高度に特殊化された組織である。軟骨の栄養は、主として滑液からの吸収によって行われる。軟骨細胞の代謝は、軟骨細胞および周辺組織によって局所的に産生される多くの可溶性因子によって調節される。軟骨細胞の機能は、細胞外培地の組成(酸素の張力、イオン濃度、pHなど)、VCMの組成、細胞と基質の相互作用、物理的信号にも依存する。実験的モデリングの主な仕事は、成熟細胞の表現型を変えずに細胞外環境で培養物を創出することである。第2の課題は、化学的および/または物理的信号に対する軟骨細胞の早期、遅延、短期間または長期間の応答を研究するための培養物を作製することである。研究in vitroではまた、変形性関節症における軟骨細胞の挙動を研究する機会を提供します。第3の課題は、共同治癒システムの開発であり、関節内の様々な組織の相互作用を研究することができる。第4の課題は、その後の移植のための軟骨移植の準備である。最後に、第5の課題は、修復を刺激し、および/または軟骨の再吸収を阻害することができる増殖因子、サイトカインまたは治療剤を研究することである。
過去数十年間、単層培養、懸濁培養、コンドーム培養、外植片、共培養、不死細胞培養を含む、関節軟骨細胞培養の様々なモデルが作製されてきた。各培養には長所と短所があり、それぞれは軟骨細胞代謝の特定の側面を研究するのに適しています。したがって、軟骨外植片は、真の細胞表面受容体および正常な細胞 - マトリックスおよびマトリックス - 細胞相互作用を必要とするマトリックス要素の代謝回転を研究するための優れたモデルである。同時に、マトリックス中の寄託物または軟骨細胞代謝の調節のメカニズムの研究は、単離された細胞の培養上で行われることが推奨される。単層低密度培養は、細胞分化の過程を研究するために必要である。天然または合成マトリックス中に懸濁された培養物は、軟骨細胞の機械的ストレスに対する適応応答を分析するためのモデルである。
軟骨細胞培養
インビトロ研究のために軟骨組織を選択する場合、いくつかの重要な点を考慮する必要があります。軟骨細胞のマトリックス組成および代謝活性は、異なる関節で異なり、後者はまた、組織中の軟骨細胞の深さに依存する。これらのデータは、異なる深度の軟骨領域からの軟骨細胞の単離された亜集団が研究されたいくつかの実験において得られた。関節軟骨の表面および深層に位置する培養された軟骨細胞の間に、多数の形態学的および生化学的な相違が見出された。表面細胞は、まれな枯渇プロテオグリカン原線維マトリックスを合成し、より深い細胞は原線維およびプロテオグリカンが豊富なマトリックスを産生する。また、表層細胞は、比較的小さな非凝集プロテオグリカンおよびヒアルロン酸とアグリカンと相対的に小さいケラタン硫酸、より深くに位置する軟骨細胞を産生します。異なる深さの軟骨領域から単離された軟骨細胞の代謝の別の重要な特徴は、外因性刺激に対する応答である。M. Aydelotteらによれば、ウシ軟骨表面領域からの軟骨細胞は、深いゾーン細胞よりもIL-1に対してより感受性でした。
細胞の挙動はまた、組織の位置に依存する。このような線維芽細胞増殖因子(FGF)、およびTGF-βなどの成長因子に異なる反応を同一の動物から採取し、軟骨および耳端を軟骨細胞。FGFは軟骨細胞リブの文化ではなく、耳にチミジン取り込み、プロリン及びロイシンを増加させました。TGF-βは、軟骨細胞のリブと耳にチミジンの取り込みを増加させたが、軟骨細胞およびプロリン耳へのチミジン取り込みに影響を及ぼしませんでした。最大の負荷を帯びたゾーンから得られた軟骨細胞は、軟骨の負荷が低い部位からの軟骨細胞とは異なる。最大荷重担持メニスカスによって覆われていないヒツジ関節脛骨骨表面の中央領域から膝関節の軟骨の例えば、成熟軟骨細胞in vivoで、小さい合成アグリカン、デコリンが、半月板によってカバーされる領域の細胞よりも大きくします。著者らはまた、関節の合成機能を調べる際に、同一の関節領域から軟骨を使用することの重要性を強調している。
軟骨細胞の代謝および調節因子に対する応答も、ドナーの年齢、その骨格の発達および細胞が採取される関節の状態に大きく依存する。ヒト軟骨細胞では、増殖応答の年齢とともに有意な減少が観察される。最大の減少は、40-50歳および60歳以上のドナーで観察されます。さらに、成長因子(例えば、FGFおよびTGF-ベータ)に対する増殖応答の重症度は、老化の間に減少する。軟骨細胞の増殖の定量的変化に加えて、質的変化もある。若いドナー細胞(10-20歳)は、TGF-ベータよりも血小板由来増殖因子(PDGF)によく反応し、逆は成人ドナー細胞で観察される。軟骨細胞の合成機能の年齢依存的変化および成長因子の影響に対するそれらの応答を説明するために、いくつかのメカニズムが使用される。その中でも、表面細胞受容体の数および親和性の減少、成長因子およびサイトカインの合成および生物活性の変化、および受容体シグナルの改変。
関節の病的状態も、軟骨細胞の形態および代謝活性を変化させる。したがって、J. Kouriおよび共同研究者(1996)は、変形性関節症の軟骨における軟骨細胞の3つの亜集団を同定した。軟骨の表層および上中間の軟骨細胞はクラスターを形成し、より多くのプロテオグリカンおよびコラーゲンを合成する。TGF-β、およびインスリン様成長因子(IGF)は、軟骨細胞によってプロテオグリカン合成を刺激し、部分的にIL-1およびTNF-αの効果を中和することができます。軟骨外植片は、変形性関節症に罹患し、変形性関節症患者の軟骨から分離された軟骨細胞は、健康な軟骨の軟骨細胞よりもTGF-βの刺激に敏感です。これらの違いは、関節軟骨の上層の軟骨細胞における表現型の変化と関連している可能性が最も高い。
個々の軟骨細胞の単離は、ECMのタンパク質分解酵素による連続処理によって達成される。単離された細胞は、ECMから放出された後、理想的には新規のマトリックス成分の合成を研究するのに適している。いくつかの著者は、クロストリジウムコラゲナーゼのみを使用し、他のものは、トリプシン、プロナーゼ、DNアーゼおよび/またはヒアルロニダーゼと軟骨をプレインキュベートする。単離された細胞の数は、使用される酵素に依存する。したがって、1gのコラゲナーゼ組織のいずれかを処理する場合は1,4T0得ることができる6 4,3-10 -プロナーゼ、ヒアルロニダーゼおよびコラゲナーゼ使用する場合に対し、軟骨細胞を6。コラゲナーゼ、アグリカン、タンパク質、IL-6、IL-8で処理すると、様々な酵素による連続処理の場合よりもはるかに細胞培養中に残る。2つの細胞培養間のこれらの相違についてのいくつかの説明がある:
- 酵素の作用によって損傷又は押下細胞受容体DNA及び単層で培養した軟骨細胞のプロテオグリカン合成(7日)は、TGF-βによって刺激しながら、TGF-βは、新たに単離された軟骨細胞(1日目)にプロテオグリカンのDNA合成を阻害します。しかしながら、これらの膜成分を再発現させるためには、実験開始前に十分な期間が必要である。
- 外因性プロテアーゼは、インテグリンによって媒介される細胞とマトリックスとの相互作用を破壊することができる。インテグリンファミリーは、軟骨細胞のVKM分子への付着を促進する(Shakibaei M.ら、1997)。この破裂は、マトリックス遺伝子の発現に影響し得る。
- マトリックス成分の残留物は、軟骨細胞の合成機能を調節することができる。インテグリンは、ECMの分解産物を認識することができ、それによってタンパク質分解酵素に曝露した後の組織修復において重要な役割を果たす。T.ラーションら(1989)は、培養細胞中の無傷または断片化プロテオグリカンの添加がタンパク質およびプロテオグリカンの合成を刺激することを報告しました。しかし、ヒアルロン酸の高いレベルは、軟骨細胞、ニワトリ胚軟骨細胞による硫酸プロテオグリカン合成の包含の有意な減少は、ブタおよびラット軟骨肉腫細胞を成熟させます。また、ヒアルロン酸 - さえIL-LB、TNF-α、FGFの存在下で細胞からのプロテオグリカン放出の阻害剤は、最初は、成長因子およびサイトカインの生物学的活性に対抗することを示します。ヒアルロン酸の作用の根底にある正確なメカニズムは依然として不明である。軟骨細胞は、サイトゾルのアクチンフィラメントに関連するヒアルロン酸の受容体を含むことが知られている。ヒアルロン酸のその受容体への結合は、タンパク質のリン酸化を刺激する。したがって、これらのデータは、膜受容体細胞を活性化することによって、マトリックスタンパク質の断片化または天然分子による軟骨細胞の代謝機能の調節を実証する。
- 軟骨細胞によるマトリックスタンパク質の合成の酵素による迅速な刺激は、軟骨細胞の形状の変化および/または細胞骨格の再構成の結果であり得る。
- いくつかのサイトカイン(例えば、IL-8)および成長因子(例えば、IGF-1、TGF-P)は、ECMに固定される。最もよく知られている例は、TGF-βとデコアとの結合であり、これはチャイニーズハムスターの卵巣細胞における細胞増殖を誘発する能力の低下をもたらす。年齢とともに軟骨の装飾の内容が増加するというデータは、老化におけるTGF-βの生物学的利用能の低下を示す。成長因子およびサイトカインは、培養中にマトリックス残基から放出され、次いで軟骨細胞機能を調節することができる。
軟骨細胞の単層培養
分化した軟骨細胞の表現型は、主にII型コラーゲンおよび組織特異的プロテオグリカンの合成ならびに低レベルの有糸分裂活性を特徴とする。単層で細胞を長期間培養すると、そしていくつかの繰り返し継代した細胞の後で、軟骨細胞は球状の輪郭を失い、細長い線維芽様の形状を獲得するという証拠がある。この線維芽細胞の化生により、コラーゲンII、IX、およびXI型の合成の漸進的減少およびコラーゲンI、IIIおよびUtyopovの合成の増加によって特徴づけられる細胞の合成機能も修飾される。小さな非凝集プロテオグリカンは、機能性アグリカンによって合成される。Synthetzatepsin BおよびLは、分化した細胞では極めて低いが、分化喪失の過程で増加する。コラゲナーゼ-1は、分化した軟骨細胞において発現され、長期間培養され、その発現は減少するが、メタロプロテアーゼ(TIMP)の組織阻害剤の産生が増加する。
分化した軟骨細胞は、単層培養から懸濁培養へ移行する際に、分化した表現型のコラーゲンを再発現する。分化のプロセスは、おそらく細胞の形状に関連している。この性質は、自己移植軟骨細胞で欠陥のある移植を研究する研究者によって定期的に使用されている。生検材料から得られた少数の細胞を単層培養で増殖させ、次いで移植前に再び三次元マトリックスに再配置することができる。アガロース培養物に移された脱分化した軟骨細胞による特定の表現型の再発現は、TGF-β、オセイン - ヒドロキシアパタイト複合体およびアスコルビン酸で刺激することができる。
増殖因子およびサイトカインの効果に応答して、軟骨細胞は分化過程の間に修飾される。サイトカインおよび成長因子に対する細胞応答は、未分化および分化した軟骨細胞間で異なる。IL-1は線維芽細胞の増殖を刺激するが、未分化軟骨細胞の増殖はIL-1によって阻害される。DNAの合成は、伸長されたが、平坦化されていない軟骨細胞ではIGF-1によって刺激される。分化した軟骨細胞において、プロコラーゲナーゼ産物に対するIL-1βおよびTNF-αの刺激効果は、未分化軟骨細胞よりも顕著である。
軟骨細胞の培養
液体培地または天然または合成の三次元マトリックス中の懸濁液中の軟骨細胞の培養は、軟骨細胞の表現型を安定化させる。細胞は球形を保持し、組織特異的タンパク質を合成する。重み付けされた軟骨細胞培養は、通常、新しい細胞周囲マトリックスの形成の研究のために推奨される。合成または天然の吸収性ポリマー中の軟骨細胞培養物を用いて、関節の軟骨組織の再生を刺激するために、細胞を軟骨欠損に移植する。移植可能な細胞のための合成または自然環境は、多くの要件を満たさなければならない:
- インプラントは、接着および細胞成長のための多孔性構造を有するべきであり、
- ポリマー自体もその分解生成物も、インビボ移植中に炎症または毒性反応を引き起こすものではなく、
- 移植キャリアは、隣接する軟骨または軟骨下骨に結合することができなければならず、
- 天然または合成のマトリックスは吸収することができなければならず、その分解は組織再生によってバランスを取らなければならず、
- 軟骨修復を促進するために、マトリックスの化学構造およびマトリックス構造は、軟骨細胞によってコードされる細胞表現型および組織特異的タンパク質の合成を維持するのに役立つはずであり、
- インビボでの移植中に、合成または天然マトリックスの機械的特性を研究することが必要である。
液相における軟骨細胞の懸濁
軟骨細胞の培養は、溶液メチルセルロース、アガロース、ヒドロゲル(ポリ-2-ヒドロキシエチルメタクリレート)又はコラーゲン - アガロースの混合物でコーティングされ、それらの壁を防止することができるプラスチック容器に細胞接着。これらの条件下で、軟骨細胞はクラスターを形成し、主にアグリカンおよび組織特異的コラーゲン(II、IX、XI型)を合成する。通常、2つのタイプの細胞が見出される。中心に位置する細胞は、組織化学的および超構造的研究によって確認され、よく発達したECMによって囲まれた球形を保持する。末梢に軟骨細胞は円板状の輪郭を持ち、まれなECMに囲まれている。そのような細胞の機能的特徴についてはほとんど知られていない。
懸濁状態で支持されたマイクロキャリア上の軟骨細胞の培養が可能である。デキストランビーズ(サイトデックス)、コラーゲン被覆デキストランビーズ(サイトデックスIII)、I型コラーゲンの非空隙マイクロスフェア(コラーゲン)をマイクロキャリアとして使用する。これらの培養条件下で、軟骨細胞は、マイクロキャリアの表面に付着し、それらの球形を保持し、マトリックス状物質を生成する。さらに、コラーゲンの使用は、軟骨細胞の増殖および正常な表現型の再発現を促進する。したがって、コラーゲンのミクロスフェア上の軟骨細胞の培養は、移植前の細胞表現型を回復させるために使用することができる。
液体培地中の軟骨細胞の懸濁液を培養する別の方法は、遠心分離によって得られた細胞(0.5-1× 10b)からなる高密度ビーズの形態での培養である。そのような軟骨細胞は、多数のプロテオグリカン、II型コラーゲンを含むマトリックスを産生することができるが、I型コラーゲンは組織学的、免疫組織化学的および定量的方法によって確認される。
自然なECMにおける軟骨細胞の懸濁
軟骨細胞は、3次元マトリックス(軟寒天、アガロース、コラーゲンゲルまたはスポンジ、ヒアルロン酸、フィブリン糊、アルギン酸ビーズ)中で懸濁状態で培養することができる。
培養されたアガロース軟骨細胞は、正常な表現型を保持し、II型コラーゲンおよび組織特異的凝集体 - 新規凝集体を合成する。アガロースで培養すると、細胞合成プロテオグリカンが培地中に50日間放出される。比較のために、単層培養では、培養の最初の5〜6日間に既に細胞相にグリコサミノグリカンが過剰充填されている; グリコサミノグリカンの合成および放出後に培地中で培養すると、グリコサミノグリカンの時間依存的な減少が最初の8〜10日で起こる。それにもかかわらず、アガロース中での培養中の軟骨細胞の挙動は、インビボ条件とは異なる。アガロースでは、多数の合成Aggregan凝集体がインビボよりも小さい分子および小さい分子を含む。TGF-Pは、外植片中のプロテオグリカンの合成を刺激するが、アガロース中のアグリカンの合成を減少させる。
アルギン酸塩は、茶色の海藻由来の直鎖状多糖類である。Ca 2+イオンのような二価カチオンの存在下では、このポリマーはゲルになる。負に帯電した多糖類のマトリックスに囲まれたアルギン酸塩に巻き込ま各軟骨細胞は、の細孔は、硝子軟骨のものと同等です。関節軟骨および天然の組織に複数のリモートマトリックスinterterritorial同等の細胞周囲と領土行列に対応するセルに関連するマトリックスの薄層- 2つのセグメントから成る、アルギン酸ビーズ中の軟骨細胞を形成されるマトリックス。培養の30日目に、細胞によって占められる相対および絶対量、およびアルギン酸ビーズ内の2つの部門の各々は、ほぼ天然の軟骨のものと全く同じです。約30日間の軟骨細胞は、それらの球形の形状を保持し、関節軟骨およびコラーゲン分子II、IX及びXI型のマトリックスにおけるアグリカン分子のものと同様であるアグリカン、流体力学的特性を生じます。同時に、他の文化、懸濁剤のような、扁平細胞の表面上にアルギン酸ビーズは、私は環境に直接放出された分子を、コラーゲンおよびVCRに組み込まれていないタイプの少量を生成することに存在します。アルギン酸ビーズにおいて、軟骨細胞の中程度の増殖が観察される。アルギン酸ゲルでの培養の8ヶ月後に成熟した軟骨細胞は代謝活性を失い、組織特異的コラーゲンタイプIIおよびアグリカンを合成し続けないでください。
N. Tanakaおよび共同研究者(1984)は、アルギン酸塩中の種々の天然分子の拡散特性を調べ、70kDより大きい分子はアルギン酸塩を通って拡散しないことを見出した。したがって、アルギン酸塩中の細胞の培養は、マトリックス生合成の調節およびECMの構成の研究に適している。アルギン酸塩中で培養された細胞の利用可能性は、転写、転写後および翻訳レベルに対するペプチド調節因子および薬理学的作用物質の効果を調べることを可能にする。
軟骨細胞はまた、コラーゲン線維IおよびII型のマトリックス中で培養される。ネイラー(Nehrer)および共同研究者(1997)は、異なるタイプのコラーゲンを含有する多孔性コラーゲン - プロテオグリカンポリマーマトリックス中の犬軟骨細胞の機能を比較した。彼らは、I型およびII型コラーゲンを含有するコラーゲンマトリックス中で培養された軟骨細胞の生合成機能の形態において重要な相違を見出した。コラーゲンII型のマトリックス中の細胞は球形に巻かれたが、I型コラーゲンでは線維芽細胞様の形態を有していた。さらに、II型コラーゲンのマトリックスにおいて、軟骨細胞はより多くのグリコサミノグリカンを産生した。J. Van Susansら(1995)は、アルギン酸塩およびコラーゲン(I型)ゲルで培養した軟骨細胞の特性を比較した。著者らは、コラーゲンゲル中の細胞数の有意な増加を見出したが、培養6日目から、細胞は特徴的な表現型を失い、線維芽細胞様細胞になった。アルギン酸塩ゲルにおいて、細胞数の減少が観察されたが、軟骨細胞は正常な表現型を保持していた。細胞当たりのコラーゲンゲルプロテオグリカンの量は、アルギン酸塩よりも有意に高かったが、アルギン酸合成で成長し続け、一方、減少は、培養の6日目から開始してゲルマトリックス要素の合成において観察されました。
固体の三次元フィブリンマトリックスは、分化した表現型で体重を測定した軟骨細胞を支持する天然物質である。3Dフィブリンマトリックスはまた、軟骨細胞移植のための担体として使用することができる。フィブリンの利点は、細胞傷害性、空間を充填する能力、接着能力の欠如である。組織学的および生化学的研究により、オートラジオグラフィー、電子顕微鏡、フィブリンゲル中の軟骨細胞は、その形態を保持し、培養して2週間後でも増殖し、マトリックスを産生することが見出されている。しかしながら、G. Hommingaおよび共同研究者(1993)は、培養3日後にフィブリンの崩壊が始まり、軟骨細胞の脱分化が進行すると報告している。
人工(合成)ECMにおける軟骨細胞の懸濁
再構築または整形外科手術のための軟骨インプラントは、合成生体適合性マトリックス中で単離された軟骨細胞をインビトロで成長させることによって得ることができる。
培養されたポリグリコール酸軟骨細胞は、8週間以内に増殖し、正常形態および表現型を維持する。軟骨細胞 - ポリグリコール酸複合体は、細胞、グリコサミノグリカン、コラーゲンからなり、外側コラーゲンカプセルを有する。しかし、このようなインプラントには、2つのタイプのコラーゲン分子IおよびIIがある。軟骨細胞の一連の継代によって脱分化されたインプラントは、主に未分化の軟骨細胞からのインプラントよりも多くのグリコサミノグリカンおよびコラーゲンを有する。
L. Freed and co-authors(1,993b)は、繊維状ポリグリコール酸(HPHC)およびポリ乳酸(PPLC)におけるヒトおよび雄性軟骨細胞培養物の挙動を比較した。著者らは、HSVGまたはPPLCにおける雄性軟骨細胞の6〜8週間の培養後に、細胞増殖および軟骨マトリックス再生を観察した。HSBCでは、軟骨細胞は球形であり、軟骨基質で囲まれた髄腔内に位置していた。8週間のin vitro培養後、再生組織は乾燥物質(細胞質量の4%、グリコサミノグリカンの15%、コラーゲンの31%)を50%まで含んでいた。PPLK細胞では、紡錘形、少量のグリコサミノグリカンおよびコラーゲンであった。HSBCでは、細胞増殖はPTCAよりも2倍強かった。条件の下では、生体内で 1-6ヶ月のEQAPとPPLCで成長した軟骨細胞我々は軟骨組織学的に類似した組織を働きました。インプラントは、グリコサミノグリカン、I型およびII型コラーゲンを含有していた。
胎児の雄性軟骨細胞を、多孔性高密度疎水性および親水性ポリエチレン中で培養した。両方の基質で7日間のインキュベーション後、細胞は球形を保持し、主にII型コラーゲンを含有していた。培養21日後、親水性マトリックスは疎水性マトリックスよりもII型コラーゲンを多く含むことが判明した。
軟骨組織は、Millicell-CMフィルター上で単層培養することによっても得ることができる。コンドロイチンを付着させるためには、フィルターをコラーゲンでプレコーティングする必要があります。培養物の組織学的検査は、プロテオグリカンおよびII型コラーゲンを含有するECMにおける軟骨細胞の蓄積を実証する。このような培養物中のI型コラーゲンは検出されない。得られる軟骨組織中の軟骨細胞は球形であるが、組織の表面上ではいくらか平滑である。新たに形成された組織の厚さは時間とともに増加し、細胞の単層の初期密度に依存した。最適な培養条件下で、軟骨組織の厚さは110μmに達し、表面および深層におけるその細胞およびコラーゲンの組織化は、関節軟骨の組織に類似している。VKMは約3倍のコラーゲンおよびプロテオグリカンを含む。2週間の培養後、マトリクスsaの蓄積が認められたので、フィルターから組織を抽出し、移植に使用することができた。
Simsら(1996)は、多数の細胞を注射によって輸送することを可能にするポリエチレンオキシド - ゲルカプセル化ポリマーマトリックス中の軟骨細胞の培養を研究した。無胸腺マウスの皮下組織に注射してから6週間後に、新しい軟骨が形成され、形態学的には、硝子軟骨に類似した白色乳白光によって特徴付けられた。組織学的および生化学的研究からのデータは、ECMを産生する活発に増殖する軟骨細胞の存在を示した。
Explantation
軟骨組織の検査は、それにおける壊死および異化、恒常性、再吸収および修復の過程を研究するために使用される。軟骨組織外植片における軟骨細胞は、インビボでの関節軟骨におけるものと同様のECMの正常な表現型および組成を支持する。血清の存在下での5日間の培養後、一定レベルの合成および自然分解が達成される。組織再吸収は、多数の薬剤、例えば、IL-1B、TNF-α、細菌性リポ多糖類、レチノイン酸誘導体または活性酸素ラジカルによる血清の添加により、本培養および培養において加速させることができる。軟骨の修復を研究するために、炎症の可溶性メディエーター(H 2 O 2、IL-1、TNF-a)またはマトリックスの物理的破裂によってその損傷が誘発される。
器官型培養の方法は、軟骨細胞および周囲のマトリックスに対する単離された外部因子のインビトロ効果を研究するためのモデルである。条件の下では、in vivoでの軟骨細胞めったにVCRに配置されていないとお互いに接触しません。外植片軟骨の培養は、この構造的組織ならびに軟骨細胞とその周囲の細胞外環境との間の特定の相互作用を保持する。このモデルはまた、機械的ストレス、薬理学的因子、成長因子、サイトカイン、ホルモンの軟骨の代謝に及ぼす影響を研究するためにも使用される。
軟骨組織の外植片の別の利点は、細胞が単離されたときに不可避である、タンパク質分解酵素または機械的因子による軟骨細胞の損傷がないことである。受容体および他の膜タンパク質および糖タンパク質は、損傷因子から保護される。
コンドロンの文化
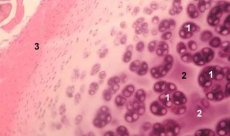
コンドロンは、軟骨細胞、その細胞周囲マトリックスおよびコンパクトフィラメントカプセルからなる関節軟骨の構造的、機能的および代謝単位であり、マトリックスのホメオスタシスの原因となる。軟骨は軟骨から機械的に抽出され、いくつかの連続した低速ホモジナイゼーションによって収集される。単一hondron、ツインhondrony、複数(3以上)の直線状に配置hondrony(カラムhondronov)hondronov輻輳:hondrony軟骨は、4つのカテゴリに分けることができ、異なる深さの領域から単離しました。
単軟骨は、通常、無傷の軟骨の中間層に見出され、中層および深層の境界上に対になって、直線的に配置された複数の軟骨は、インタクトな軟骨の深い層に典型的である。最後に、コンドロンのクラスターは、ホモジナイゼーション後に凝集した状態を保持する無作為に編成された単一およびペアドコンドロンのグループからなる。軟骨の集積は、軟骨の大きな断片であり、通常、いくつかの軟骨および放射状に配置されたコラーゲン線維、すなわち、マトリックスの深層の典型的な組織特性を含む。軟骨細胞は、その構造、分子組成および代謝活性を研究することを可能にする透明アガロース中に固定化されている。Hondronシステム - アガロース軟骨の伝統的なシステムとは異なる軟骨のマイクロモデルとして考える - 天然の微小環境を保持したアガロースは、その合成及び組み立てを行う必要がありません。軟骨の培養は、正常および病理学的状態における関節軟骨における細胞およびマトリックスの相互作用を研究するためのモデルである。
 [22], [23], [24], [25], [26], [27]
[22], [23], [24], [25], [26], [27]
不朽の軟骨細胞の培養
永久細胞株を作製するために、細胞を「不滅」にすることができる組換えDNAまたはオンコゲン含有ウイルスが使用される。不滅の軟骨細胞は、安定した表現型を維持しながら、無限の増殖能を有する。F. Mallein-GERINら(1995)癌遺伝子は、マウス従って安定コラーゲンIIを発現し続ける軟骨細胞、IX及びXI型のSV40T誘導性増殖、ならびに関節およびアグリカン結合タンパク質であることを示しました。しかし、そのような細胞系は、単層培養またはアガロースゲルで培養した場合に、I型コラーゲンを合成する能力を獲得する。
W. Hortonおよび共著者(1988)は、低レベルのコラーゲンII型mRNA発現を有する不死細胞の系列を記載した。これらの細胞は、I-myc-およびγ-ra-癌遺伝子を含むマウスレトロウイルスでそれらを形質転換することによって得られた。このタイプの細胞は、II型コラーゲンの非存在下における関節マトリックスの相互作用ならびにII型コラーゲンの合成の調節を研究するための独特のモデルである。
突然変異または欠損遺伝子を有する軟骨細胞の培養は、それらの生理学的機能を研究するための好都合なモデルである。このモデルは、軟骨基質の組織内の特定の分子の役割を研究または軟骨代謝への様々な調節因子の効果を研究するために特に適しています。軟骨細胞リモート遺伝子は、コラーゲンIX型は、線維の直径を調節することを示し、通常よりも広いコラーゲンIX型コラーゲン原線維を合成しました。私は、第1章、主に一般変形性関節症を有する家族で新たに発見された遺伝子変異COLAI符号化タイプIIコラーゲンで述べたように。関節マトリックス中に変異型コラーゲンIIの効果を研究するためにR. Dharmrvaramら(1997)(「汚染」は、外来核酸)が不良COLトランスフェクションを行った2ヒト胎児軟骨細胞でAI(位置519のアルギニンがシステインによって置き換えられる)インビトロです。
共存のシステム。関節において、軟骨は、滑膜、滑液、靭帯、軟骨下骨に含まれる他のタイプの細胞と相互作用する。軟骨細胞の代謝は、これらの細胞によって合成された様々な可溶性因子によって影響され得る。したがって、関節炎の関節軟骨は、タンパク分解酵素および滑膜細胞によって産生されるフリーラジカルによって破壊される。したがって、共培養と呼ばれる軟骨と周囲組織との複雑な相互作用を研究するためのモデルが開発されている。
S.ラコンブ-Gleiseら(1995)細胞を、微多孔膜(0.4ミクロン)を分離した共培養系(COSTAR)中で培養したウサギ軟骨細胞および骨芽細胞であった任意の直接接触なしに2つの細胞型間の交換を可能にします。この研究は、骨芽細胞が可溶性メディエーターを介して軟骨細胞の成長を刺激する能力を実証した。
A.M. Malfait and co-authors(1994)は、末梢血単球と軟骨細胞との関係を調べた。このモデルは、サイトカイン、炎症性関節症(慢性関節リウマチ、血清陰性脊椎炎など)において媒介される過程を研究するのに都合がよい。モデルの著者は、直径0.4μmの孔を有するタンパク質結合膜によって細胞を分離した。研究では、リポ多糖刺激単球がiFNO IL-1-A、アグリカン軟骨細胞の合成を阻害し、既に合成されたアグリカン凝集物の分解に寄与して働いたことがわかりました。
K.多田ら(1994)は、内皮細胞におけるコラーゲン(I型)のゲルを0.4ミクロンの細孔サイズを有するフィルタに軟骨細胞によってそれから分離された外側チャンバから内側チャンバに入れた共培養モデルを作成しました。外部チャンバーから完全に単離された状態で、ヒト内皮細胞は、EGFまたはTGF-αの存在下でコラーゲンゲル中にチューブを形成した。両方のタイプのTGF細胞の同時培養では、内皮細胞による管の依存的な形成が阻害された。このプロセスの軟骨細胞阻害は、抗TGF-β抗体によって部分的に排除された。軟骨細胞によって産生されたTGF-βは、軟骨自体の血管新生を抑制すると推定される。
S. Grootおよび共同研究者(1994)は、脳組織の断片を有する16日齢の胎児マウスの骨の肥大および増殖領域から軟骨細胞を同時に培養した。培養の4日後、軟骨細胞の骨芽細胞への分化転換および骨形成の開始が観察された。培養11日後、軟骨の一部を骨組織に置き換え、骨マトリックスを部分的に石灰化させた。脳組織によって産生され、骨芽細胞の代謝に影響を及ぼすか、または受容体を有する神経ペプチドおよび神経伝達物質の中には、その中でも、ノルエピネフリン、血管作用性腸管ペプチド、 カルシトニン遺伝子に関連するペプチド、サブスタンスPおよびソマトスタチンを単離することができる。軟骨細胞で培養された脳組織は、これらの因子のいくつかを産生し、軟骨細胞の分化を骨芽細胞に誘導することができる。
 [28], [29], [30], [31], [32], [33]
[28], [29], [30], [31], [32], [33]
外部因子が軟骨細胞の培養に及ぼす影響
軟骨細胞の代謝に及ぼす酸素張力の影響
ほとんどの場合、軟骨細胞培養は大気酸素圧の条件下で発達する。それにもかかわらず、生体内軟骨細胞は低酸素条件下で存在し、酸素の張力は異なる病的状態によって変化することは周知である。成熟プロセスの間に、骨端の血液供給の有意な変化が観察される。血管新生は成長プレートの異なる領域で変化するので、それらの酸素張力もまた変化する。C. Brighton and R. Heppenstall(1971)は、ウサギの脛骨のプレートにおいて、肥大ゾーンの酸素張力が周囲の軟骨よりも低いことを実証した。いくつかの代謝パラメータの測定は、軟骨細胞が酸素濃度の局所的変化に迅速に反応することができることを示している。まず、低い酸素張力で、軟骨細胞の消費が減少する。酸素張力が21〜0.04%に低下すると、グルコース利用が増加し、解糖酵素活性および乳酸合成が増加する。低い酸素張力でも、ATP、ADPおよびAMPの絶対量は安定したままである。これらのデータは、軟骨細胞代謝の指向性がエネルギー節約を最大にすることを示している。それにもかかわらず、合成活性、したがって償還過程は、低酸素状態下で変化する。
高い酸素張力は、軟骨細胞の代謝にも影響し、プロテオグリカンおよびDNAの合成の低下、軟骨基質の分解を引き起こす。これらの影響は、原則として、遊離酸素ラジカルの生成を伴う。
軟骨細胞の機能に及ぼす環境のイオン濃度と浸透圧の影響
細胞外培地中のナトリウム含有量は250 - 350ミリモル、その浸透圧 - 350~450ミリオスモル:ネイティブ軟骨イオン濃度の他の組織のものとは大きく異なっています。VCRから軟骨細胞を分離し、標準のメディアでそれらをインキュベートすると(DMEM(ダルベッコ最小必須培地 - ダルベッコ最小必須培地)浸透圧 - 250-280,7のmOsm)、細胞の急激周囲の環境が変化します。さらに、標準培地中のカルシウムおよびカリウムの濃度は、天然組織よりもずっと低く、アニオンの濃度ははるかに高い。
培地へのスクロースの添加は、その浸透圧の増加をもたらし、サイトゾル中のH +およびカルシウムアニオンの濃度の一時的な細胞内増加を誘導する。このような細胞内変化は、軟骨細胞分化のプロセスおよびそれらの代謝活性に影響を及ぼす可能性がある。J. Urbanら(1993)は、標準的なDMEM培地中で2〜4時間インキュベートした単離軟骨細胞との35 8硫酸および3 H-プロリンの取り込みは、天然組織におけるもののわずか10%であることを見出した。新たに単離された軟骨細胞および軟骨組織の外植片の両方において、350-400mosmolの細胞外培地の浸透圧モル濃度で、合成の強度は最大に達した。さらに、前記モル浸透圧濃度の標準的なDMEM培地中に単離された細胞を配置した後、軟骨細胞容積は30〜40%増加した。しかし、軟骨細胞を非生理的浸透圧下で12〜16時間培養すると、細胞は新しい状態に適応し、細胞外培地の浸透圧に比例して生合成の強度を減少させる。
P. Borgettiら(1995)は、細胞外成長培地に、形態、およびブタ軟骨細胞の生合成のオスモル濃度の効果を調べました。著者らは、浸透圧ミリオスモル0.28と0.38との培地中で培養した軟骨細胞の同様の生化学的および形態学的特徴を示しました。場合、培養の最初の4~6時間の間に培地の0.48ミリオスモルの浸透圧は、細胞増殖及びタンパク質合成の減少を観察したが、その後、最終的に制御値に達し、これらのパラメータを復元発生しました。0.58ミリオスモルの浸透圧細胞と培地中で軟骨細胞を培養する際に生理学的強度増殖プロセスをサポートする能力を失い、6日後の軟骨細胞の数が大幅に低減されます。培地の浸透圧モル濃度が0.58モルでは、タンパク質合成の深い阻害が観察される。加えて、培養した場合浸透圧を有する培地中では顕在化損失特性の表現型変換を軟骨細胞として0,28-0,38軟骨細胞は、(ミリオスモル0,48-0,58)より高い浸透圧で細胞形態の著しい変化を、生理的表現型を保持ミリオスモル線維芽細胞様細胞への分化、ならびにマトリックスプロテオグリカンをアセンブルする能力である細胞喪失を含む。この研究の結果は、軟骨細胞が細胞外環境におけるオスモル濃度振動に応答する能力を示している。
他のイオンの濃度の変化はまた、軟骨細胞における生合成のプロセスに影響し得る。したがって、5mmol(標準DM DM培地中の濃度)から10mmol(in vivoでのVKM濃度)のカリウムイオンの濃度の増加に伴って、35 S(硫酸塩)の含有率が半分に増加する。成熟した雄の軟骨細胞によるコラーゲン産生に0.5mmol未満のカルシウム濃度が寄与したが、1-2mmolの濃度(標準DM DM培地中の濃度に相当)はコラーゲン合成の有意な低下を引き起こした。高レベルのカルシウム(2〜10ミリモル)で生合成の中程度の増加が観察された。種々のカチオンが、軟骨細胞のVKMタンパク質への結合に関与する。したがって、マグネシウムイオンおよびマンガンイオンは、フィブロネクチンおよびII型コラーゲンへの結合を提供するが、カルシウムイオンは、軟骨細胞のタンパク質への結合に関与しない。したがって、記載された研究の結果は、培地のカリウム、ナトリウム、カルシウムおよび浸透圧の細胞外イオンの変化が、標準培地でインキュベートした軟骨細胞の生合成機能に及ぼす影響を示す。
軟骨細胞の代謝に及ぼす機械的ストレスの影響
関節の固定化は軟骨の可逆的な萎縮を引き起こし、これはECMにおける代謝プロセスの通常の過程のための機械的刺激の必要性を示す。ほとんどの場合、使用される細胞培養モデルは通常の大気圧条件下で存在する。M. Wrightおよび共著者(1996)は、機械的環境が軟骨細胞の代謝に影響を与えることを示し、細胞の応答は、圧縮負荷の強度および頻度に依存する。インビトロでインタクトな関節軟骨の外植片に負荷する実験は、静的負荷の作用下でのタンパク質およびプロテオグリカンの合成の減少を示し、動的負荷はこれらの過程を刺激する。軟骨に対する機械的ストレスの効果を実現するための正確なメカニズムは複雑であり、おそらく細胞変形、静水圧、浸透圧、電位および表面細胞レセプターからマトリックス分子に関連している。これらのパラメータのそれぞれの影響を調べるには、1つのパラメータを個別に変更できるシステムを作成する必要があります。例えば、外植片培養は細胞の変形を研究するのには適していないが、軟骨細胞の代謝活性に及ぼす圧力の全体的な効果を研究するために使用することができる。軟骨の圧縮変形をセルに導き、また、静水圧勾配、電位、及び流体流変化物理化学的マトリックス中の水分含有量、電荷密度、浸透圧のレベルなどの要因の発生を伴います。細胞の変形は、アガロースまたはコラーゲンゲルに浸漬した単離軟骨細胞を用いて研究することができる。
軟骨細胞の培養に対する機械的刺激の影響を研究するためのいくつかのシステムが開発されている。いくつかの研究者は、気相を通して細胞培養に圧力が加えられるこの目的のためにシステムを使用する。例えば、JP Veldhuijzenら(1979)、15分の間、低周波数(0.3ヘルツ)で13キロパスカルの大気圧以上の圧力を使用して、cAMP合成及びプロテオグリカンの増加及びDNA合成を低下させることを観察しました。R. Smithら(1996)は、一定の圧力がこれらのプロセスに影響を及ぼさなかったのに対し、4時間1Hzでの軟骨細胞の雄牛静水圧力(10 MPa)との一次培養物の断続的曝露は、アグリカン及びコラーゲンII型の合成の増加を引き起こしたことを示しました。同様のシステムM.ライトら(1996)を使用して、細胞培養で周期的圧力が軟骨細胞およびCaの活性化の細胞膜の過分極に関連していることが報告さ2+依存性カリウムチャネル。従って、周期的な圧力の影響は、軟骨膜において、伸張によって活性化されるイオンチャネルによって媒介される。静水圧に対する軟骨細胞の応答は、細胞培養の条件および適用される負荷の頻度に依存する。このように、周期的な静水圧(5MPaで)は、一方軟骨外植片増加で0.5 Hzの封入硫酸上記周波数に対して、0.05、0.25及び0.5ヘルツの周波数で軟骨細胞単層に硫酸の取り込みを減少させます。
ブッシュマン(M. Bushmann)ら(1992)は、アガロースゲル中の軟骨細胞は、培養されたインタクトな器官と同様に静的および動的機械的ストレスに応答して生合成を変化させることを報告している。著者らは、機械的負荷が高浸透圧刺激を生成し、続いて軟骨細胞のpHが低下することを見出した。
機械的ストレッチの影響は、ゲルに浸した細胞の培養物について研究することができる。伸張力は、コンピュータ制御真空を用いて作り出すことができる。システムがある程度の真空状態にあるとき、細胞培養を伴うペトリ皿の底部はある量だけ伸長し、変形はカップの底部の縁部で最大であり、中心部で最小である。ストレッチングは、軟骨細胞のシャーレで伝達され、培養される。この方法で、ホルム-バルK.ら(1995)(II型)コラーゲンで培養ゲル軟骨細胞はmRNAの発現と増加することが示された2 -integrinaを。2 p個のRのインテグリンは、コラーゲンタイプIIに結合することができます。それは、アクチビン結合タンパク質と相互作用し、それによってECMと細胞骨格とを連結するため、機械受容体と考えられる。
軟骨細胞代謝に対するpHの影響
軟骨組織のECMの間質液のpHは、他の組織よりも酸性である。A.Maroudas(1980)は、関節軟骨のpHを6.9で決定した。Diamant and co-authors(1966)は、病理学的条件においてpH5.5を見出した。軟骨細胞は低PO2で生存することが知られており、これらの細胞の代謝における解糖(総グルコース代謝の95%)の重要な役割を示している。解糖は大量の乳酸の生成を伴う。
解糖生成物による環境の酸性化に加えて、マトリックス成分自体が非常に重要である。細胞外プロテオグリカン上の固定負電荷の多数のイオン組成を変更:フリーカチオン(例えばHの高い濃度がある+をNa +、K +)と陰イオンの低い濃度(例えば、O2、NPHSは)。さらに、機械的負荷の作用下で固定された負電荷の増加した濃度をもたらし、マトリックスのその他の陽イオンを引き付けるECMからの水の排除を生じます。このことにより、軟骨細胞の代謝を改変する、細胞内pHに影響を与える細胞外培地のpHを低下が続いています。R.ウィルキンとA.ホール(1995)は、ウシ軟骨細胞を単離された細胞外および細胞内環境マトリックス生合成のpHの影響を研究しました。彼らは、pHの低下を伴うマトリックス合成の二重修飾を観察した。pHのわずかな減少(7.4
 [34], [35], [36], [37], [38], [39], [40]
[34], [35], [36], [37], [38], [39], [40]
培養培地の組成が軟骨細胞の代謝に及ぼす影響
軟骨細胞を培養するための培地は、実験条件に対応していなければならない。近年、ウシ血清を用いて培養条件を最適化している。しかし、血清を使用する場合、いくつかの重要な点を考慮する必要があります:
- 器官培養物中の組織の周辺からの細胞の外部成長、
- 種々のシリーズの血清の組成の変動性、
- その中に未知の成分が存在すること、
- 細胞の代謝活性に及ぼす様々な生物学的因子の影響の研究における干渉の危険性の増大、アーチファクト。
後者の例は、ラットの軟骨軟骨細胞に対するEGFの効果の研究である。EGFは、3 H-チミジンの取り込みおよび培養物中のDNA含量の増加を刺激した。この効果は、低血清濃度(<1%)でより顕著であったが、高濃度(> 7.5%)では効果は消失した。
ウシ血清で富化されたDMEMにおける合成および分解のレベルは、インビボ条件と比較して有意に増加することは周知である。インビボおよびインビトロ代謝の差は、滑液と細胞が培養される環境との間の相違によって引き起こされ得る。D. Leeら(1997)は、若い雄牛は、20%ウシ血清および同種正常滑液多数の富化DMEMを含有する栄養培地を用いてアガロース培養軟骨細胞でした。培地中の滑液の存在は、滑液の全量の80%までのプロテオグリカンの数の増加を誘導した。得られた結果は、培養中の滑液が、グリコサミノグリカン合成のレベルが高く、細胞分裂のレベルが低い、インビボでのものと同様の代謝速度を誘導することを示している。
G. Verbruggenら(1995)の合成したことを示した35血清を含まないDMEM中のアガロース中で培養したS-arrpeKaHaヒト軟骨細胞は10%ウシ血清を補充したDMEM中で観察された合成のレベルの20~30%でした。著者らは、程度を決定れるIGF-1、IGF-2、TGF-P、または血清を含まない培地中で減少したインスリン産生アグリカン。著者らは、対照レベルの39から53パーセントにアグリカンの100ng / mlのインスリン、IGF-1又はIGF-2部分還元合成と結論づけました。これらの要因の組み合わせにより、相乗的または累積的な現象は確認されていない。同時に、100ng / mlのインスリンの存在下でTGF-P 10ng / mlの基準レベルの90%以上にアグリカンの合成を刺激しました。最後に、血清トランスフェリンを、単独でまたはインスリンと組み合わせて、アグリカンの合成に影響を与えなかった。子牛血清をウシ血清アルブミンで置換すると、アグリカンの凝集物含量が有意に減少した。インスリン、IGF、又はTGF-Pとの富化培地は、部分的にアグリカン凝集体を産生する細胞の能力を復元します。この場合、IGF-1およびインスリンは、細胞培養においてホメオスタシスを維持することができる。10-20 / mlのIGF-1を添加した培地での培養の40日後、プロテオグリカン合成を同じレベルまたはより高い、20%ウシ血清を含む培地と比較して維持しました。異化プロセスは、0.1%のアルブミン溶液を添加した培地においてよりもIGF-1を添加した培地中でゆっくりと進行し、やや速く培地中20%血清を補充しました。長寿命の培養では、20ng / mlのIGF-1は安定した細胞状態を維持する。
D. Leeら(1993)は、外植片軟骨の培養におけるDNA合成、単層培養およびアガロースで懸濁液中に培養培地の組成物の効果(DMEM、DMEM + 20%ウシ血清、DMEM + 20ng / mlのIGF-1)と比較し。ときは、アガロース中で培養した血清著者の存在下では、大規模な濃度の軟骨細胞のグループ化する傾向が観察されました。無血清およびIGF1と共に培養した細胞は、アガロースで円形の形状を保持する、小グループに収集されたが、大きな凝集体を形成しませんでした。単層では、DNAの合成はIGF-1を富化した培地よりも血清含有培地で有意に高かった。後者のDNAの合成は、濃縮されていない環境よりもはるかに高かった。IGF-1、DNA合成の差がないと未濃縮培地中で、培地中で、アガロース中に懸濁した軟骨細胞を培養します。同時に、血清を補充した培地中で、アガロース中に軟骨細胞を培養するスラリーは、放射性ヌクレオチドの取り込みの増加を伴った3他の環境に比べてHチミジン。
ビタミンCは、安定した螺旋構造のコラーゲン線維の形成に関与する酵素の活性化に必要である。アスコルビン酸に関して不十分な軟骨細胞は、緩慢に分泌されるコラーゲンの非ヒドロキシル化非ヘリックス前駆体を合成する。アスコルビン酸(50μg/ ml)の導入はII型およびIX型のコラーゲンのヒドロキシル化およびそれらの分泌を正常量で引き起こす。ビタミンCの添加は、プロテオグリカンの合成レベルに影響しなかった。その結果、コラーゲンの分泌はプロテオグリカンの分泌とは独立して調節される。


