記事の医療専門家
新しい出版物
重症敗血症と敗血症性ショックの治療
最後に見直したもの: 04.07.2025
敗血症の効果的な治療は、感染部位の完全な外科的衛生と適切な抗菌療法によってのみ可能となります。初期の抗菌療法が不十分であることは、敗血症患者の死亡リスク因子となります。患者の生命を維持し、臓器機能障害を予防・除去するには、標的を絞った集中治療が不可欠です。
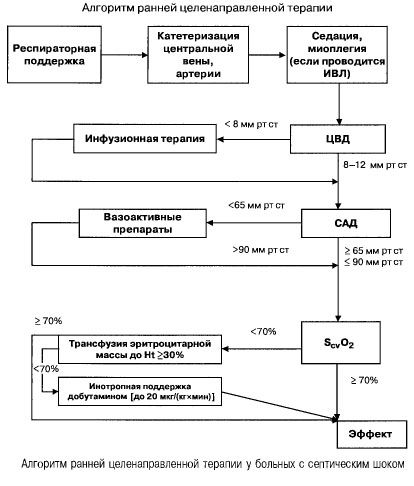
その主な目的は、重症敗血症および敗血症性ショックに典型的に見られる酸素消費量の増加状況下での酸素輸送を最適化することです。この治療は、血行動態および呼吸サポートを通じて実施されます。
血行動態サポート
点滴療法
輸液療法は、血行動態、とりわけ心拍出量を維持するための初期治療の一つです。敗血症患者における主な目的は以下のとおりです。
- 適切な組織灌流の回復、
- 恒常性障害の修正、
- 細胞代謝の正常化、
- 敗血症カスケードメディエーターおよび毒性代謝物の濃度の低下。
多臓器不全および敗血症性ショックを伴う敗血症では、次の重要な指標の値を迅速に(最初の 6 時間以内に)達成するよう努めます。
- ヘマトクリット >30%、
- 利尿0.5ml/(kgh)、
- 上大静脈または右心房の血中飽和度 >70%、
- 平均血圧 >65 mmHg、
- CVP 8~12 mmHg
これらの値を規定レベルに維持することで、患者の生存率が向上します(エビデンスカテゴリーB)。スワンガンツカテーテルとPICCO技術(経肺熱希釈法および脈波解析)を用いた血行動態モニタリングは、血行動態療法の有効性のモニタリングと評価の可能性を広げますが、生存率を向上させるというエビデンスはありません。
最適な前負荷値は、肺内皮損傷の程度、肺のリンパドレナージの状態、心室拡張機能、胸腔内圧の変化を考慮する必要があるため、個別に選択される。輸液療法の量は、PCWPが血漿COP(OLの予防)を超えず、COが増加するように選択される。さらに、肺のガス交換機能を特徴付けるパラメータ(paO 2およびpaO 2 /FiO 2)とX線画像の変化も考慮される。
敗血症および敗血症性ショックの標的治療の一環としての輸液療法では、晶質溶液とコロイド溶液が使用され、実質的に同様の結果が得られます。
すべての輸液媒体には長所と短所があります。現在、実験および臨床研究の結果を踏まえると、特定の種類を優先する理由はありません。
- 例えば、静脈還流と前負荷レベルを適切に補正するには、コロイドの2~4倍の量の晶質液を投与する必要があります。これは、体内の溶液分布の特殊性に関係しています。さらに、晶質液の注入は組織浮腫のリスクが高く、血行動態への影響はコロイドよりも短くなります。同時に、晶質液はより安価で、凝固能に影響を与えず、アナフィラキシー様反応を引き起こしません。上記に基づき、輸液プログラムの質的構成は、患者の特性、血液量減少の程度、DIC症候群の段階、末梢浮腫の有無、血清中のアルブミン濃度、急性肺損傷の重症度を考慮して決定されます。
- 重度のBCC欠乏症には、血漿代替物(デキストラン、ゼラチン製剤、ヒドロキシエチルスターチ)が適応となります。置換度200/0.5、130/0.4、および130/0.42のヒドロキシエチルスターチは、膜外への漏出リスクが低く、止血に臨床的に有意な影響を与えないことから、デキストランよりも潜在的な利点があります。
- 重篤な状況下でのアルブミン投与は、死亡リスクを高める可能性があります。アルブミン投与中のCOPの上昇は一時的であり、その後、毛細血管床の透過性亢進(「毛細血管漏出」症候群)の状態下では、アルブミンのさらなる血管外漏出が起こります。アルブミン輸血は、血清中のアルブミン濃度が20g/l未満であり、間質への「漏出」の兆候がない場合に限り有効となる可能性があります。
- クライオプラズムの使用は、消費性凝固障害および血液凝固能の低下に適応します。
- ドナー赤血球塊の広範な使用は、様々な合併症(APL、アナフィラキシー反応など)の発生リスクが高いため、制限されるべきです。多くの専門家によると、重症敗血症患者のヘモグロビン濃度の最小値は90~100g/lです。
低血圧の矯正
灌流圧が低い場合は、血管緊張や心筋の変力作用を高める薬剤を直ちに投与する必要があります。敗血症性ショックの患者における低血圧の改善には、ドパミンまたはノルエピネフリンが第一選択薬です。
10μg/(kg x 分)未満の用量のドパミン(ドプミン)は、主に心拍出量の増加によって血圧を上昇させますが、全身血管抵抗への影響は最小限です。高用量では、αアドレナリン作用が優位となり、動脈収縮を引き起こします。一方、5μg/(kg x 分)未満の用量では、ドパミンは腎臓、腸間膜、冠動脈のドパミン受容体を刺激し、血管拡張、糸球体濾過の増加、およびNa+排泄を引き起こします。
ノルエピネフリンは平均血圧を上昇させ、糸球体濾過量を増加させます。ノルエピネフリンの作用下で全身血行動態が最適化されることで、低用量ドパミンを併用することなく腎機能の改善が期待できます。近年の研究では、ノルエピネフリン単独使用は、高用量ドパミンとの併用と比較して、死亡率を統計的に有意に低下させることが示されています。
アドレナリンは、最も顕著な血行動態的副作用を有するアドレナリン作動薬です。用量依存的に、心拍数、平均血圧、心拍出量、左室機能、酸素供給量および消費量に影響を与えます。しかしながら、頻脈性不整脈、臓器血流低下、高乳酸血症が同時に発現します。そのため、アドレナリンの使用は、他のカテコラミン系薬剤に完全に反応しない場合にのみ制限されます。
ドブタミンは、正常または高い前負荷において、 COおよびO2の供給量と消費量を増加させる最適な薬剤です。β1アドレナリン受容体に優位に作用するため、これらのパラメータを増加させる効果はドパミンよりも優れています。
実験研究により、カテコールアミンは血行促進作用に加え、遠隔作用を持つ主要なメディエーターの合成に影響を及ぼすことで全身性炎症の進行を調節することが示されています。アドレナリン、ドーパミン、ノルアドレナリン、ドブタミンの影響下では、活性化マクロファージはTNF-αの合成と分泌を抑制します。
アドレナリン剤の選択は、次のアルゴリズムに従って実行されます。
- 心係数3.5-4 l/(分 x m 2 )、SvO 2 >70% - ドーパミンまたはノルエピネフリン、
- 心係数<3.5 l/(min x m 2 )、SvO 2 <70% - ドブタミン(収縮期血圧<70 mm Hgの場合はノルエピネフリンまたはドパミンと併用)。
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
呼吸サポート
肺は、敗血症の病態過程において最初に関与する標的臓器の一つです。急性呼吸不全は、多臓器不全の主要な構成要素の一つです。敗血症におけるその臨床的および臨床検査的所見はALIに相当し、病態の進行に伴いARDSに相当します。重症敗血症における機械的人工呼吸器の適応は、実質性呼吸不全(ARFまたはARDS)の重症度に応じて決定されます。その基準となるのは呼吸指数です。
- <200 - 気管挿管と呼吸補助が適応となる、
- >200 - 読み取り値は個別に決定されます。
酸素補給下での自発呼吸中に患者が意識があり、呼吸仕事量の増加や顕著な頻脈(HR <120/分)が認められず、静脈還流SO 2の正常値が90%を超える場合は、人工呼吸器への移行を控えることができます。ただし、患者の状態を注意深く監視する必要があります。SO 2の最適値は約90%です。この値は、様々なガス供給方法(フェイスマスク、鼻腔カテーテル)によって、非毒性濃度(FiO 2 <0.6)で維持できます。敗血症(エビデンスカテゴリーB)では、非侵襲性人工呼吸器は禁忌です。
高容量機械的換気(MVV)モード(VO = 12 ml/kg)は避けるべきです。このような場合、肺からのサイトカイン分泌が増加し、MOFの増悪につながるからです。安全な機械的換気の概念を遵守する必要があり、以下の条件を満たす場合に可能です(エビデンスカテゴリーA)。
- DO <10 ml/kg、
- 吸入と呼気の非反転比率、
- 気道内圧ピーク<35cmH2O、
- FiO2 <0.6 。
呼吸サイクルパラメータの選択は、適切な機械的換気が達成されるまで実行され、その基準は、paO2 > 60 mm Hg、SpO2 > 88〜93%、pvO2 35〜45 mm Hg、SvO2 > 55% です。
ガス交換を最適化する効果的な方法の一つは、腹臥位(Prone Positioning)での人工呼吸器の使用です(エビデンスカテゴリーB)。この体位は最も重症の患者には効果的ですが、長期的な死亡率低下効果は統計的に有意ではありません。
栄養サポート
敗血症における多臓器不全症候群の発症は、通常、代謝亢進の症状を伴うため、人工栄養補給は治療の重要な要素であり、必須の措置の一つです。このような状況では、エネルギー需要は自身の細胞構造の破壊(自己共食い)によって満たされ、臓器機能不全を悪化させ、エンドトキシン症を増加させます。
栄養補給は、カタラーゼと代謝の顕著な増加を背景とした重度の消耗(タンパク質エネルギー欠乏)を予防する方法と考えられています。強化療法の一環として経腸栄養を組み込むことで、腸内細菌叢の乱れや腸内細菌叢異常を防ぎ、腸管上皮細胞の機能活性を高め、腸粘膜の保護特性を高めます。これらの要因により、エンドトキシン症の程度と二次感染合併症のリスクが低下します。
栄養補給の計算:
- エネルギー値 - 25~35 kcal/(体重kg×1日)
- タンパク質量 - 1.3~2.0 g/(体重kg×1日)
- 炭水化物(グルコース)の量 - 6g/kg/日未満、
- 脂肪量 - 0.5~1g/kg/日、
- グルタミンジペプチド0.3~0.4 g/kg/日、
- ビタミン - 標準1日セット + ビタミンK (10 mg/日) + ビタミンB1およびB6 ( 100 mg/日) + ビタミンA、C、E、
- 微量元素 - 標準1日量+亜鉛(15~20 mg/日+軟便がある場合は10 mg/日)
- 電解質 - 血漿中のバランス計算と濃度に応じたNa+、K+、Ca2+。
栄養補給の早期開始(24~36 時間)は、特に経腸チューブ栄養の場合、集中治療の 3~4 日目よりも効果的です(エビデンス カテゴリー B)。
重症敗血症においては、経腸栄養と静脈栄養のどちらにも利点はありません。臓器不全の期間、呼吸補助および強心薬による補助の期間、そして死亡率も同じです。上記を考慮すると、早期の経腸栄養は静脈栄養よりも安価な代替手段となります。経管栄養に食物繊維(プレバイオティクス)を豊富に含む混合物を使用することで、重症敗血症患者の下痢の発生率が大幅に減少します。
体内でタンパク質を効果的に合成するには、代謝比「総窒素(g)-非タンパク質カロリー(kcal)」=1-(110-130)を維持することが重要です。炭水化物の最大摂取量は6g/(体重1kg/日)です。これは、多量の摂取は高血糖や骨格筋における異化作用の活性化を招く恐れがあるためです。脂肪乳剤は24時間体制で投与することが推奨されます。
栄養補給の禁忌:
- 代償不全代謝性アシドーシス、
- 栄養補給媒体に対する個人の不耐性、
- 回復しない重度の血液量減少、
- 難治性ショック - ドーパミン投与量 >15 mcg/(kg x 分) かつ収縮期血圧 <90 mm Hg、
- 重篤な難治性動脈性低酸素血症。
血糖コントロール
重症敗血症の複合治療において重要な点は、血漿中のグルコース濃度の継続的なモニタリングとインスリン療法です。高血糖とその是正の必要性は、敗血症の予後不良因子となります。上記の状況を踏まえ、患者は正常血糖(4.5~6.1 mmol/l)を維持し、グルコース濃度が許容値を超えた場合にはインスリン注入(0.5~1 U/h)を行います。臨床状況に応じて、グルコース濃度は1~4時間ごとにモニタリングされます。このアルゴリズムを実施した結果、患者の生存率が統計的に有意に向上することが確認されました。
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
グルココルチコイド
敗血症性ショックの患者におけるグルココルチコイド使用の有効性に関する最近の研究の結果は、次のように要約されています。
- 高用量のホルモン剤の使用は不適切である(メチルプレドニゾロン30~120 mg/(kg x day)を1回または9日間、デキサメタゾン2 mg/(kg x day)を2日間、ベタメタゾン1 mg/(kg x day)を3日間)。院内感染のリスクが高まるが、生存率には影響がない。
- ヒドロコルチゾンを1日240~300 mgの用量で5~7日間使用すると、血行動態パラメータの安定化が促進され、血管サポートの中止が可能になり、同時に相対的副腎機能不全を患う患者の生存率が向上します(エビデンスカテゴリーB)。
プレドニゾロンとデキサメタゾンの混乱した経験的処方は放棄する必要がある。新たな情報をこれらに外挿する根拠はない。相対的副腎機能不全の臨床的証拠がない場合、ヒドロコルチゾンを1日300mg(3~6回注射)投与する。
- 難治性ショックの場合、
- 有効な血行動態を維持するために高用量の血管収縮薬が必要な場合。
敗血症性ショックにおける全身性炎症状態において、ヒドロコルチゾンの有効性は、核因子κB阻害因子(NF-κB-α)の活性化および相対的副腎機能不全の改善に関連している可能性がある。また、転写核因子(NF-κB)の活性阻害は、誘導性NO合成酵素(NOは最も強力な内因性血管拡張因子である)、炎症性サイトカイン、COX、および接着分子の形成を減少させる。
活性化プロテインC
敗血症の特徴的な症状の一つは、全身凝固系の破綻(凝固カスケードの活性化と線溶の阻害)であり、最終的には低灌流と臓器機能不全につながります。活性化プロテインCは炎症系にいくつかの作用を及ぼします。
- 白血球へのセレクチンの付着の減少は、内皮を損傷から保護し、全身性炎症の発生に重要な役割を果たします。
- 単球からのサイトカイン放出の減少、
- 白血球からのTNF-αの放出を阻害し、
- トロンビン生成の阻害(炎症反応を増強する)。
抗凝固作用、線維素溶解促進作用、抗炎症作用
- 活性化プロテインCは、
- Va因子とVIIIa因子の分解 - 血栓形成の抑制、
- プラスミノーゲン活性化因子阻害因子の抑制 - 線溶の活性化、
- 内皮細胞と好中球に対する直接的な抗炎症作用、
- 内皮細胞のアポトーシスからの保護
活性化プロテインC(ドロトレコギン アルファ(活性型))を24mcg/(kg/h)で96時間投与すると、死亡リスクが19.4%減少します。投与適応:急性MOFを伴う高死亡リスク敗血症(APACHE IIスコア25点超、2臓器以上の機能不全、エビデンスカテゴリーB)。
活性化プロテイン C は、小児、単一臓器機能不全の患者、APACHE II が 25 ポイント未満の患者、非外科的敗血症の患者では死亡率を低下させません。
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
免疫グロブリン
免疫グロブリン(IgGおよびIgG+IgM)の静脈内投与は、炎症性サイトカインの過剰な作用を抑制し、エンドトキシンおよびブドウ球菌性スーパー抗原のクリアランスを高め、アネルギーを解消し、β-ラクタム系抗生物質の効果を高めるという点で、推奨されます。重症敗血症および敗血症性ショックの治療における免疫グロブリンの使用は、生存率を向上させる唯一の免疫補正法です。IgGとIgMの併用投与において、最も良好な効果が記録されました(相対リスク0.48(0.35-0.75)、エビデンスカテゴリーA)。標準的な投与レジメンは、3~5 mL/kg×日を3日間連続投与です。免疫グロブリンを用いた場合、最も良好な結果が得られたのは、ショックの初期段階(「温熱ショック」)および重症敗血症患者(APACHE IIスコア20~25点)でした。
深部静脈血栓症の予防
下肢深部静脈血栓症(DVT)の予防は、敗血症患者の治療成績に大きく影響します(エビデンスカテゴリーA)。この目的では、未分画ヘパリンと低分子量ヘパリンの両方が用いられます。低分子量ヘパリンの主な利点は、出血性合併症の発生率が低いこと、血小板機能への影響が弱いこと、そして効果が持続すること(1日1回投与可能)です。
胃腸管のストレス潰瘍の形成予防
重症敗血症および敗血症性ショックの患者において、消化管のストレス性潰瘍からの出血による死亡率は64~87%であるため、この方針は良好な転帰を得る上で重要な役割を果たします。予防措置を講じない場合、重症患者の52.8%にストレス性潰瘍が発生します。しかし、プロトンポンプ阻害薬とヒスタミンH2受容体遮断薬の使用により、リスクは2倍以上低減します(前者の薬剤群は後者よりも効果的です)。予防と治療の主な方針は、pHを3.5~6.0に維持することです。上記の薬剤に加えて、経腸栄養がストレス性潰瘍の形成予防に重要な役割を果たすことを強調しておく必要があります。
体外血液浄化
全身性炎症の発生に関与する様々な生理活性物質や代謝産物は、解毒法の標的であり、多臓器不全において自然な肝腎クリアランスが機能しない場合には特に重要です。腎代替療法は、腎不全患者の尿毒症性疾患に効果があるだけでなく、敗血症、ショック、多臓器不全において生じる恒常性の変化や臓器機能不全にもプラスの影響を与える可能性があるため、有望視されています。
これまでのところ、敗血症および敗血症性ショックの病態治療における主要な方向性の一つとして体外血液浄化法を用いる必要性を裏付けるデータはありません。腎優位の多臓器不全の場合、体外血液浄化法の使用は正当化されます。
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
血液透析
この方法の本質は、低分子量(最大5x10 3 Da)の物質を半透膜を通して拡散させ、圧力勾配に沿って体内の余分な水分を除去することです。血液透析は、慢性腎不全および急性腎不全の患者の治療に広く用いられています。物質の拡散速度は、その分子量に指数関数的に依存します。例えば、オリゴペプチドの除去速度は、その合成速度よりも遅くなります。
血液濾過
血液濾過は、分子量5×10 3~5×10 4 Daの物質を除去する効果的な方法であり、体内から多くの生理活性物質と代謝産物を除去する唯一の方法です。この方法は、物質移動の対流法に基づいています。高窒素血症を適切に改善するだけでなく、血液濾過はアナフィラトキシンC3a、C5a、炎症性サイトカイン(TNF-α、IL-1β、IL-6、IL-8)、β2ミクログロブリン、ミオグロビン、副甲状腺ホルモン、リゾチーム(分子量:6000 Da)、α-アミラーゼ(分子量:36,000~51,000 Da)、クレアチンホスホキナーゼ、アルカリホスファターゼ、トランスアミナーゼなどの物質を効果的に除去します。血液濾過は、アミノ酸と血漿タンパク質(免疫グロブリンと循環免疫複合体を含む)を除去します。
血液透析濾過
血液透析濾過は、拡散と対流(GDとGF)を組み合わせた、最も強力な血液浄化法です。病原物質をフィルター膜に吸着させることで、解毒プロセスにさらなる貢献を果たします。
血漿交換
血漿交換(血漿交換、血漿濾過)は、敗血症および敗血症性ショックの患者における全身性炎症の治療方法として考えられています。最適な方法は、連続モードで血漿交換を行い、3~5倍量の血漿を除去し、同時に新鮮凍結、アルブミン、コロイド溶液、晶質溶液に置き換えることです。ふるい係数が1である血漿濾過は、C反応性タンパク質、ハプトグロビン、補体フラグメントC3、l-アンチトリプシン、IL-6、トロンボキサンB2、顆粒球刺激因子、TNFを十分に除去します。患者の血漿を精製するために吸着剤を使用すると、外来タンパク質を使用する必要がないため、感染のリスクが低減し、処置のコストも削減されます。
重症敗血症において、亜セレン酸ナトリウム(セレナーゼ)1000 mcg/日の長期点滴投与は死亡率の低下につながります。
セレンは必須微量元素であり、その重要性は細胞の抗酸化システムにおける重要な役割と関連しています。血中セレン濃度は1.9~3.17μM/Lに維持されます。セレンの必要量は1日50~200μgで、他の抗酸化物質や微量元素の利用可能性に依存します。
セレンは強力な抗酸化物質であり、グルタチオンペルオキシダーゼ、ホスホリングルタチオンペルオキシダーゼ、その他の酸化還元酵素、そしていくつかのトランスフェラーゼの成分です。グルタチオンペルオキシダーゼは、内因性抗酸化システムにおいて最も重要な役割を果たします。
近年、重篤な疾患におけるセレンの有効性について研究が行われています。これらの研究により、セレンの主な作用機序は以下のとおりであることが示されています。
- NF-κBの過剰活性化の抑制;
- 補体活性化の低下;
- 免疫調節剤、抗酸化剤、抗炎症剤としての作用
- 過酸化物の利用を維持する;
- 内皮接着の抑制(ICAM-1、VCAM-2の発現低下)
- E - セクレチン、P - セクレチン);
- 内皮をオキシラジカルから保護する(O2とNOからペルオキシナイトライトの形成を防ぐセレノプロテインPを使用)。
上記をまとめると、重症敗血症に対する集中治療の具体的なタスクを次のように定義できます。
- 血行動態サポート: CVP 8~12 mm Hg、平均血圧 >65 mm Hg、利尿 0.5 ml/(kg h)、ヘマトクリット >30%、混合静脈血飽和度 >70%。
- 呼吸サポートの最高気道内圧は 35 cm H2O 未満、吸気酸素分率 60% 未満、一回換気量 10 ml/kg 未満、吸気呼気比は反転していない。
- グルココルチコイド - 「低用量」(ヒドロコルチゾン 1 日 240 ~ 300 mg)。
- 重症敗血症(APACHE II >25)の場合、活性化プロテインC 24 mcg/(kg h)を4日間投与。
- ペンタグロビンによる免疫補正補充療法。
- 下肢深部静脈血栓症の予防。
- 胃腸管のストレス潰瘍形成の予防:プロトンポンプ阻害剤およびH2ヒスタミン受容体遮断薬の使用。
- 急性腎不全に対する補充療法。
- 栄養補給:食物のエネルギー値 25~30 kcal/(体重 kg x 日)、タンパク質 1.3~2.0 g/(体重 kg x 日)、グルタミンジペプチド 0.3~0.4 g/(kg x 日)、グルコース - 非タンパク質カロリーの 30~70% (ただし血糖値が 6.1 mmol/l 未満に維持されることを条件)、脂肪 - 非タンパク質カロリーの 15~50%。


