記事の医療専門家
新しい出版物
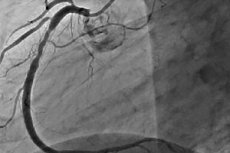
経管的バルーン冠動脈形成術(TBCA)後の再狭窄
TBCA後、最初の6か月の再狭窄率は30~40%です。その主な発症メカニズムは、血管の局所的なネガティブリモデリングであり、本質的には、処置中にバルーンによって拡張された動脈内腔の弾性虚脱です。局所的な血栓形成と新生内膜の成長も相対的な役割を果たしています。TBCA後の再狭窄の危険因子には、臨床的(2型糖尿病、急性冠症候群(ACS)、再狭窄の既往)、血管造影(LAD病変、小血管径、慢性完全閉塞(CTO)、長い病変、変性した静脈バイパスグラフト)、および手順的(大きな残留狭窄、バルーン拡張の結果としての血管径の小さな増加)があります。再狭窄の場合は、通常、繰り返し介入が行われます。再狭窄部位での繰り返しTBCAの成功率は、最初の手順に匹敵します。しかし、再狭窄に対するTBCAを繰り返すごとに、再発性再狭窄のリスクは著しく増加します。3回目以降では、このリスクは50~53%に達します。さらに、TBCAを繰り返すごとに、再狭窄の進行は初回よりも顕著になります。再狭窄に対する2回目のTBCA後の再狭窄のリスク因子としては、初回再狭窄の早期出現(術後60~90日)、LAD損傷、多枝損傷、2型糖尿病、高血圧、不安定狭心症、および初回処置中の複数回のバルーン拡張などが挙げられます。再狭窄の頻度の高さとその発生メカニズムを踏まえ、冠動脈ステントが臨床診療に導入されました。これにより、理論上はTBCA後の負の血管リモデリングが排除されるはずでした。
ステント留置の有効性を実証した最初の研究は、1993年に発表されたSTRESS研究とBENESTENT研究でした。BENESTENT試験には、直径3 mmを超える冠動脈狭窄と新たに診断された516人の患者が含まれ、従来のTBCA群(n = 257)とステント留置を伴うTBCA群(n = 259)の2つのグループに無作為に割り付けられました。3年後、血管造影中の再狭窄率は、従来のTBCA群で32%、ステント留置群で22%でした。再狭窄率の相対的減少率は31%でした(p < 0.01)。また、ステント群では心筋血行再建術の再実施の必要性が低く(従来のTBCA群で10%対20.6%、p < 0.01)、これはステント群での狭心症再発率の低下と関連していました。
STRESS試験(n = 407)によると、ステント留置群(n ~ 205)の再狭窄率は、従来のPTCA群(n = 202)と比較して低く、31.6%対42.1%(p < 0.01)でした。PTCA留置部位の再狭窄において、従来の血管形成術よりもステントを使用する利点は、再狭窄患者383名をステント留置群または再経皮経管的冠動脈形成術群に無作為に割り付けたREST試験で実証されました。血管造影で検出された再狭窄率は、ステント留置群で18%低かった(18%対5.32%、p < 0.03)。臨床的に有意な再狭窄の指標となる心筋血行再建術の繰り返しも、ステント留置群では有意に減少しました(10% vs 27%、p < 0.001)。このように、ステント留置による良好な結果は、自己動脈だけでなく、TBCA後に発生した再狭窄に対する介入においても実証されました。
ベアステント留置後の再狭窄(BSI)
被覆なし冠動脈ステントはTBCAと比較して再狭窄の発生率を30~40%低減させましたが、17~32%の患者はステント留置後もステント内再狭窄を発症し、再血行再建術が必要となります。ステント内狭窄(ISS)の発生機序はTBCAとは異なります。ステント留置後、再狭窄の主な原因は新生内膜の形成であり、TBCAではステント留置部位ではほとんど認められませんが、新生内膜は平滑筋細胞の遊走と増殖によって細胞外マトリックスを産生し、この細胞が新生内膜を形成します。さらに、糖尿病患者においては、ステント留置部位における血栓の持続も重要です。
ステント内狭窄(ISS)の主な分類は、Mehаnが提唱した分類であり、病変の範囲と重症度に応じて4つのタイプに分類されます。I型ISS - 局所性(長さ10mm未満)、II型 - びまん性(長さ10mm超)、III型 - 増殖性(長さ10mm超でステントを越えて広がる)、IV型 - 閉塞につながるISSです。I型は、ステント内の位置に応じてサブタイプに分けられます。1a型 - 屈曲部またはステント間、1b型 - 辺縁性、1c型 - ステント内、1d型 - 多巣性です。
VRS発症の危険因子としては、静脈バイパスグラフトへの介入、慢性閉塞、入口部病変、小血管径、残存狭窄の存在、VRSに対するステント留置、術後小血管径、左下行枝病変、長いステント長、糖尿病の存在、1つの病変への複数ステントの留置などが挙げられます。遺伝的因子、特に糖タンパク質IIIa遺伝子の多型およびメチレンテトラヒドロ葉酸還元酵素遺伝子(インターロイキン-1をコードする遺伝子)の変異の影響が示唆されています。ステント辺縁部再狭窄の発症の場合、主な危険因子はステント留置部における顕著な動脈硬化病変です。
再狭窄は主に経皮的冠動脈形成術後の最初の 6 ~ 8 ヶ月に発生します。ほとんどの患者は、ほぼ同時に臨床症状を呈します。VRS は通常、再発性狭心症として発現します。不安定狭心症はそれほど頻繁ではありません (症例の 11 ~ 41%)。AMI は患者の 1 ~ 6% に発生します。したがって、ステント留置後 1 ~ 6 ヶ月の期間における狭心症の最も一般的な原因は VRS の発症であり、通常は繰り返し血行再建術が必要になります。VRS の治療にはいくつかの方法があります。従来の TBCA を行うことができ、これによりステントがさらに拡張し (最終的な血管径の増加の 56% を占める)、新生内膜がステント セルを押し通されます (最終的な径の増加の 44% を占める)。ただし、ほとんどの場合、介入部位に残留再狭窄が観察されます (平均 18%)。さらに、TBCA術後、11%の症例で再血行再建術が必要となり、多枝病変、低左室駆出率、静脈バイパスグラフトへの介入、または初回VRSの早期発症例において、より多く必要となります。TBCA術後のVRS再発リスクは病変の種類によっても異なり、局所再狭窄の場合は10%、ステント内閉塞の場合は80%です。VRS部位へのLESの留置は、TBCA単独の場合と比較して再発リスクを低減しません。
VRSの2つ目の治療法は密封小線源療法です。密封小線源療法では、放射線源を冠動脈内腔に導入することで平滑筋細胞の増殖を抑制し、再狭窄のリスクを低減します。しかし、機器の高コスト、手技の技術的複雑さ、そして晩期ステント血栓症(LT)の発生率増加などの理由から、密封小線源療法は臨床応用からほぼ完全に排除されています。
VRS治療における画期的な出来事は、薬剤溶出ステントの導入でした。生体動脈におけるLESと比較して、薬剤溶出ステントはVRSのリスクを70~80%低減します。すでにVRSを発症した患者に対するDESの有効性に関する最初のデータは、TAXUS III患者レジストリで得られました。このレジストリでは、このような患者にSPG1を使用した場合、6か月後のVRS再発頻度はわずか16%で、前述のTBCAを用いた研究よりも低くなっています。LES再狭窄に対するSES留置後の患者を含むTRUEレジストリでは、9か月後に再血行再建術が必要となった患者は5%未満で、主に糖尿病およびACS患者でした。TROPICAL試験では、再狭窄部位へのDES留置後の患者における再狭窄の頻度を、治療方法として密封小線源治療を用いたGAMMA IおよびGAMMA II試験のデータと比較しました。 6ヵ月後、再発性再狭窄の発生率はSPS群で有意に低かった(9.7 vs 40.3%、p < 0.0001)。ステント血栓症と心筋梗塞の発生率もSPS群で低かったことは注目すべきことである(TS 0.6 vs 3.9%、p = 0.08、MI - 1.8 vs 9.4%、p = 0.004)。SPSが密封小線源治療よりも優れていることは、無作為化SISR試験で確認された。この試験では、NSCでVRSを発症した384人の患者が密封小線源治療群またはSPS植込み群に無作為に割り付けられている。9ヵ月後、再血行再建の必要性は密封小線源治療後(19.2%)の方がSPS植込み群(8.5%)よりも高く、再狭窄の再発がより頻繁に起こったことを反映している。 3年後も、再発性ステント再狭窄による再血行再建の必要性を低減するという点で、SPSの優位性は維持されていた(19% vs 28.4%)。血栓症の発生率には両群間に有意差は認められなかった。
SPS留置後のLES患者における再発性VRS発症の主な要因は、血管径が小さい(2.5mm未満)、びまん性再狭窄、そして血液透析を必要とする慢性腎不全の存在です。ランダム化試験TAXUS V ISRにおいて、SPSはVRSの治療においても高い有効性を示し、密封小線源治療と比較して再発性再狭窄率を54%減少させました。
VRSおよびDES植込みに対するTBCAの有効性を比較する無作為化試験も実施されました。無作為化試験RIBS-IIでは、9ヵ月後、DES植込み後の再発再狭窄はTBCA後よりも72%少なく、再発血行再建の必要性が30%から11%に減少しました。ISAR DESIRE試験では、VRSに対するTBCAの有効性をSPPまたはSPS植込みと比較しました。6ヵ月後、両方のDESは再発再狭窄の予防にTBCAよりも効果的であることが判明しました(再発再狭窄の発生率はTBCAで44.6%、SPSグループで14.3%、SPSグループで21.7%)。これにより、再発血行再建の必要性が減少しました。SPPとSPSを直接比較すると、SPSはSPPよりも再発血行再建の必要性を有意に効果的に減少させました(8%対19%)。したがって、DES の移植により、TBCA および密封小線源療法の両方と比較して再発性 LES VRS の発生率が低下し、PCI の繰り返し回数も減少するため、そのような患者には DES の移植が最適な処置となります。
薬剤溶出ステント(DES)留置後の再狭窄
DES を使用すると LES と比較してステント内狭窄の発生率が 70~80 % 減少したにもかかわらず、ステント留置によるこの医原性の結果の発生を完全に排除することはできませんでした。その全体的な発生率は平均して 10 % 未満のままです。再狭窄の発生率の量的な減少に加えて、発生する再狭窄の種類も大幅に変化しました。そのため、DES 植え込み後の再狭窄は通常は局所的です。臨床的には、LES の場合と同様に、安定狭心症の再発として現れることが最も多く (77 %)、無症候性の場合も少ない (8 %)。症例の 5 % では不安定狭心症として現れ、10 % では最初の症状として非 Q 波心筋梗塞が見られます。DES 再狭窄を発症する主な要因は、2 型糖尿病、小血管径、および病変の範囲です。このような患者の治療については明確な推奨事項はありません。代替案としては、DES(同種または異種)の再植込み、TBCA、または密封小線源治療が挙げられます。2度目のDES植込みによる再狭窄率は平均24%で、同種のDESを植え込む場合でも異種のDESを植え込む場合でも同じです。



 [
[