新しい出版物
がん患者が化学療法を受ける際、ほとんどの薬剤の投与量は患者の体表面積に基づいて計算されます。これは、患者の身長と体重を考慮した式を用いて推定されます。この式は1916年にわずか9人の患者のデータに基づいて策定されました。
この簡略化された投与量設定では、他の要因が考慮されていないため、患者に投与される薬剤の量が多すぎたり少なすぎたりする可能性があります。その結果、一部の患者は化学療法による不必要な毒性を感じたり、効果が不十分だったりする可能性があります。
化学療法の投与精度を向上させるため、MITのエンジニアたちは、患者ごとに投与量を個別化できる代替アプローチを開発しました。このシステムは、患者の体内の薬剤量を測定し、そのデータをコントローラーに送信することで、投与速度を適宜調整します。
このアプローチは、体組成、遺伝的素因、化学療法誘発性の臓器毒性、他の薬剤や食品との相互作用、化学療法薬を分解する酵素の概日リズム変動などによって引き起こされる薬物動態の違いを補うのに役立つ可能性があると研究者らは述べている。
「薬物の代謝機構に関する理解の進歩を認識し、工学ツールを適用して個人に合わせた投与を簡素化することで、多くの薬物の安全性と有効性を向上させることができると信じている」と、マサチューセッツ工科大学(MIT)の機械工学准教授で、ブリガム・アンド・ウィメンズ病院の消化器専門医であり、この研究論文の筆頭著者でもあるジョバンニ・トラヴェルソ氏は述べた。
MITの大学院生であるルイス・デリダー氏は、医学誌「Med」に掲載された論文の筆頭著者である。
継続的な監視
この研究では、研究者らは大腸がんなどのがん治療に用いられる5-フルオロウラシルという薬剤に焦点を当てました。この薬剤は通常46時間かけて投与され、投与量は患者の身長と体重(体表面積の推定値)に基づく計算式を用いて決定されます。
しかし、このアプローチは、薬剤の体内分布に影響を与える体組成の違いや、薬剤の代謝に影響を与える遺伝的変異を考慮していません。これらの違いは、薬剤を過剰に投与した場合に有害な副作用を引き起こす可能性があります。また、薬剤の投与量が不十分であれば、期待通りに腫瘍を死滅させられない可能性があります。
「同じ体表面積を持つ人でも、身長や体重、筋肉量、遺伝子などが大きく異なる可能性があります。しかし、身長と体重をこの式に当てはめて体表面積が同じになる限り、放射線量は同じです」と、ハーバード大学-MIT健康科学技術プログラムの医療工学および医療物理学プログラムの博士課程候補者であるデリダー氏は言う。
血液中の薬剤量を特定の時点で変動させるもう一つの要因は、5-フルオロウラシルを分解するジヒドロピリミジン脱水素酵素(DPD)と呼ばれる酵素の概日リズムです。体内の他の多くの酵素と同様に、DPDの発現は概日リズムによって制御されています。そのため、DPDによる5-FUの分解は一定ではなく、時間帯によって異なります。こうした概日リズムにより、点滴中の患者の血液中の5-FU量は10倍も変動する可能性があります。
「体表面積を用いて化学療法の投与量を計算することで、5-フルオロウラシルの毒性が人によって大きく異なることが分かります。ある患者は、ある治療サイクルでは毒性が最小限だったのに、次のサイクルではひどい毒性を経験することがあります。サイクルが進むにつれて、患者の化学療法の代謝に何らかの変化が生じたのです。私たちの時代遅れの投与量算出法ではこうした変化を捉えることができず、結果として患者は苦しんでいるのです」と、ダナ・ファーバーがん研究所の臨床腫瘍医で、この論文の著者でもあるダグラス・ルビンソン氏は述べています。
化学療法における薬物動態の変動を補正する方法の一つに、治療薬物モニタリングと呼ばれる戦略があります。この方法では、患者は1つの治療サイクルの終了時に血液サンプルを採取します。このサンプル中の薬物濃度を分析した後、必要に応じて次のサイクルの開始時に投与量を調整します(通常、5-フルオロウラシルの場合は2週間後)。
このアプローチは患者の転帰を改善することが示されていますが、5-フルオロウラシルなどの化学療法では広く使用されていません。
MITの研究者たちは、患者にとってより良い結果につながるような、薬剤投与をリアルタイムで個別化できる自動化された形で同様のモニタリングを開発したいと考えていた。
閉ループシステムでは、薬物の濃度を継続的に監視することができ、この情報を使用して化学療法薬の注入速度を自動的に調整し、投与量を目標範囲内に維持します。
この閉ループシステムにより、薬物代謝酵素レベルの概日リズムや、化学療法誘発性臓器毒性など、前回の治療以降の患者の薬物動態の変化を考慮して、薬物投与量を個別化することができます。
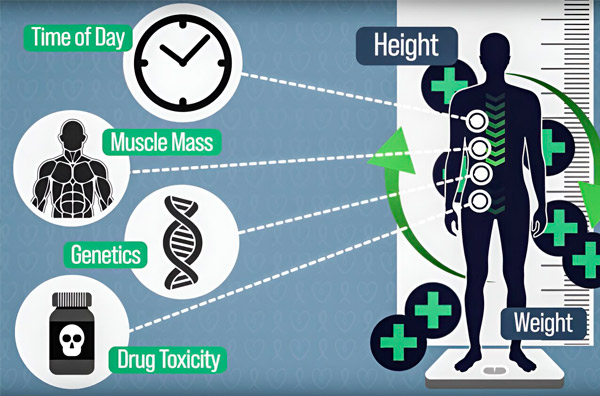
化学療法の投与量をより正確にするため、MITのエンジニアたちは、数時間にわたる点滴中に患者の体内の薬剤量を継続的に測定する方法を開発しました。これにより、体組成、遺伝、薬剤の毒性、概日リズムによる差異を補正できるようになります。出典:研究者提供。
研究者らが開発した新システム「CLAUDIA(Closed-Loop AUtomated Drug Infusion regulAtor)」は、市販の機器を各ステップに使用します。5分ごとに血液サンプルを採取し、迅速に分析準備を行います。血中5-フルオロウラシル濃度を測定し、目標範囲と比較します。
目標濃度と測定濃度の差は制御アルゴリズムに入力され、薬剤が有効で毒性のない濃度の範囲内に投与量を維持するために、必要に応じて注入速度が調整されます。
「私たちは、薬物の濃度を継続的に測定し、それに応じて注入速度を調整して薬物の濃度を治療範囲内に維持できるシステムを開発した」とデリダー氏は言う。
クイック調整
研究者らは動物実験で、CLAUDIAを使用することで体内を循環する薬剤の量を約45パーセントの時間で目標範囲内に維持できることを発見した。
CLAUDIAを使用せずに化学療法を受けた動物では、薬物濃度が目標範囲内に留まったのは平均でわずか13%でした。研究者らは本研究で薬物濃度の有効性を検証していませんが、目標範囲内の濃度を維持することで、より良い転帰が得られ、毒性も軽減されると考えられます。
CLAUDIAは、DPD酵素を阻害する薬剤を投与した場合でも、5-フルオロウラシルの投与量を目標範囲内に維持することができました。この阻害剤を投与された動物では、継続的なモニタリングと調整を行わずに、5-フルオロウラシルの濃度が最大8倍に上昇しました。
このデモンストレーションでは、研究者らは市販の機器を使用してプロセスの各ステップを手動で実行しましたが、今後は各ステップを自動化し、人間の介入なしに監視と投与量の調整を行えるようにする予定です。
薬物の濃度を測定するために、研究者らは、ほぼあらゆる種類の薬物の検出に適応できる技術である高速液体クロマトグラフィー質量分析法(HPLC-MS)を使用しました。
「適切な薬物動態特性を持ち、HPLC-MS で検出可能なあらゆる薬剤に CLAUDIA を使用できるようになる将来が期待されます。これにより、さまざまな薬剤の個別投与が可能になります」と DeRidder 氏は言います。

