新しい出版物
イリノイ大学の研究者たちは、HIV治療において特定の細胞種を標的とすることの重要性を実証しました。米国科学アカデミー紀要(Proceedings of the National Academy of Sciences)に掲載されたこの研究は、骨髄で産生される免疫細胞の一種である骨髄系細胞に対するHIV潜伏期調節の、異なる、あるいは細胞種特異的な影響を検証した初の研究の一つです。
HIV感染撲滅における主な障害の一つは、潜伏期、つまり感染細胞が休眠状態にあり、ウイルスを産生できない期間を管理することです。潜伏状態のHIV細胞は、体内のリザーバーと呼ばれる場所に集まります。潜伏状態のリザーバーは、いつでもウイルスを産生し始める可能性があるため、問題となります。
疾患を完全に根絶するには、体内の潜伏細胞をすべて除去するか、活性化刺激に対する永続的な抵抗性を獲得する必要がある。しかし、骨髄細胞の分化を誘導するシグナルなど、様々な要因によって再活性化が引き起こされる可能性がある。
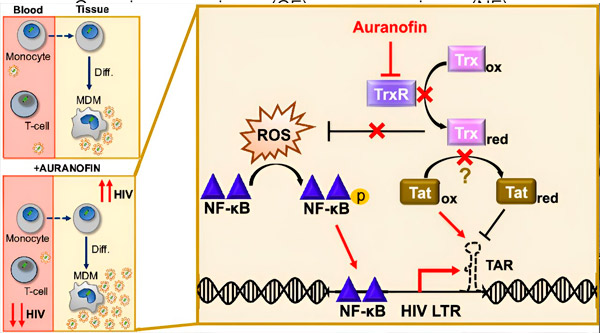
単球由来マクロファージ(MDM)におけるHIV潜伏状態の制御は、ウイルス拡散のリスクとなる可能性がある。単球からマクロファージへの分化はHIVの再活性化を引き起こし、組織へのウイルス拡散を促進する可能性がある(左上)。臨床候補薬であるオーラノフィンは、血中のウイルスDNAを減少させ、T細胞および単球におけるHIV潜伏状態を促進するが、MDMではHIVの再活性化を引き起こす(左下)。MDMにおいて、オーラノフィンによるTrxR阻害は活性酸素種(ROS)の蓄積につながり、NF-κB活性化およびHIV LTRプロモーターの活性化を誘導すると考えられる(右)。TrxR阻害は基質還元を減少させ、Tatタンパク質が優先的に酸化された状態を維持できるようにすることで、TARに結合し、HIV転写を開始する可能性がある。出典:米国科学アカデミー紀要(2024年)。 DOI: 10.1073/pnas.2313823121
長年にわたり、HIV治療研究は「ショック・アンド・キル」と「ブロック・アンド・ロック」と呼ばれる2つのアプローチを中心に行われてきました。前者は抗レトロウイルス療法と組み合わせて、潜伏感染細胞を活性化し、アポトーシス(プログラム細胞死)によって死滅させます。一方、後者は感染細胞を自力で再活性化できない深い潜伏状態に追い込みます。
これらの技術に関する研究は、従来、HIV感染の主な標的であるT細胞と呼ばれる白血球の一種に焦点を当ててきました。しかし、潜在性リザーバーはT細胞だけで構成されているわけではありません。実際には、数十種類の異なる細胞種が含まれており、それぞれが独自のHIV遺伝子発現パターンを持っています。
「単一の系統内でさえ、細胞の多様性は極めて大きい」と、微生物学助教授で論文著者のコリン・キーファー氏は述べた。「これらのリザーバーにおける反応の多様性は、新たな細胞の種類が増えるごとに増大する」
キーファー研究室の大学院生、アレクサンドラ・ブランコは、従来のHIV研究では見落とされてきた細胞種を研究したいと考えました。骨髄細胞に焦点を当て、潜伏感染した単球の70集団を含むクローンライブラリーを作成しました。ブランコはクローン集団と活性化に対する反応を分析しました。反応は大きく異なり、単一の細胞種の中にも大きな多様性があることを浮き彫りにしました。
この観察から新たな疑問が浮かび上がりました。異なる細胞の種類は、HIV潜伏期治療に対する反応が本当に異なるのでしょうか?実際、彼らの研究結果は、一部のHIV潜伏期治療薬がT細胞と単球の潜伏期を促進する一方で、マクロファージの潜伏期を逆転させることを示しました。
「体内の細胞は全て同じではありません」とキーファー氏は述べた。「ですから、感染した細胞全てがウイルスに対して同じように反応するわけではないのは当然です。」
彼らの論文は、将来の HIV 治療ではすべての細胞タイプを考慮し、各細胞が潜在的な治療法にどのように反応するかを考慮する必要があることを強調しています。
彼らの研究結果は、イリノイ大学の元生物工学教授で、HIV遺伝子発現の異質性を研究していたロイ・ダー氏の研究に基づいています。
「彼が始めたものを私たちが引き継ぎ、今日の形にまで築き上げました」とキーファー氏は述べた。「ですから、この共同研究こそが、まさにこれらの成果の出発点となったのです。私たちの研究室にとって新たな方向性を示し、大変興奮しています。」
ブランコ氏の分析から得られた予想外の新たな知見は、感染に反応して細胞の大きさと形状が変化するというものであり、HIVが細胞形態を変化させる可能性があることを示唆しています。ブランコ氏の次の目標は、これらの表現型変化の背後にある生物学的メカニズムを解明することです。
キーファー氏と研究室のメンバーは、主に細胞株で得られた結果を初代細胞で再現することを楽しみにしている。よりヒトに近いモデルで結果を再現できれば、本研究の臨床的意義が高まるとキーファー氏は説明した。
「T細胞、単球、マクロファージを対象に、より大規模なスクリーニングを実施し、これらすべての細胞種に作用する可能性のある薬剤を特定したいと考えています」とブランコ氏は述べた。「細胞種特異的な挙動を示さない分子が、さらに多く見つかるかもしれません。」

