神経内科ケン・アンド・ルース・デイビー神経腫瘍学部門の教授であるシー・ユアン・チェン博士の研究室による研究で、神経膠腫細胞における選択的RNAスプライシングの基盤となる新たなメカニズムが特定され、新たな治療標的となる可能性が示唆されました。この研究結果は、Journal of Clinical Investigation誌に掲載されています。
「私たちは選択的スプライシングという観点から神経膠腫を治療する新たな方法を発見し、これまで特定されていなかったが神経膠腫の悪性度にとって重要な新たな標的を発見しました」と神経学准教授で本研究の筆頭著者である医学博士、シャオ・ソン氏は述べた。
神経膠腫は成人における原発性脳腫瘍の中で最も一般的な種類であり、中枢神経系に存在し、隣接するニューロンを支えるグリア細胞から発生します。神経膠腫は、腫瘍の遺伝的およびエピジェネティックな異質性のために、放射線療法や化学療法などの標準的な治療に対して高い抵抗性を示し、新たな治療標的の発見の必要性を浮き彫りにしています。
チェン研究室による以前の研究は、Cancer Research誌に掲載され、重要なスプライシング因子SRSF3が正常な脳と比較して神経膠腫で著しく増加しており、SRSF3によって制御されるRNAスプライシングが腫瘍細胞内の複数の細胞プロセスに影響を及ぼして神経膠腫の成長と進行を促進することを示した。
RNA スプライシングは、イントロン (RNA の非コード領域) を除去し、エクソン (コード領域) を結合して、細胞内での遺伝子発現をサポートする成熟した mRNA 分子を形成するプロセスです。
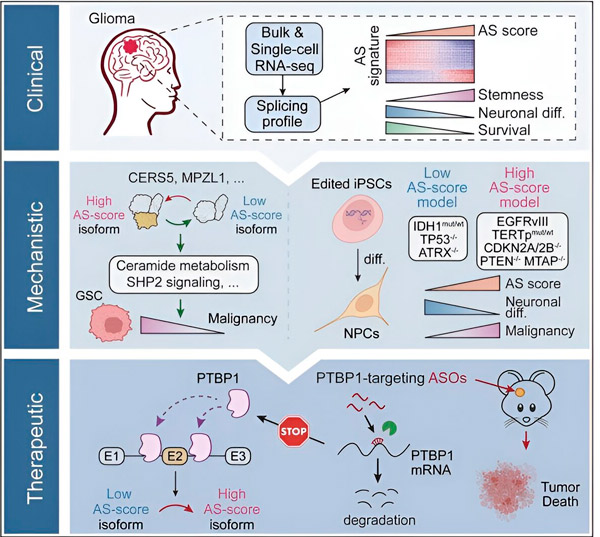
本研究では、神経膠腫腫瘍細胞における選択的スプライシングの変化、これらの変化の根底にあるメカニズムを特定し、治療標的としての可能性を判断することを科学者らは目的としました。
研究者らは、計算論的手法とRNAシーケンシング技術を用いて、患者サンプル由来の神経膠腫腫瘍細胞におけるスプライシング変化を解析した。これらの変化を確認するため、CRISPR遺伝子編集技術を用いて、ヒト人工多能性幹細胞(iPSC)由来の神経膠腫モデルに、様々な神経膠腫ドライバー変異を導入した。
研究者らは、これらのスプライシングの変化は、神経膠腫を含む多くの腫瘍で過剰発現することが知られている上皮成長因子受容体III(EGFRIII)の変異体によって促進され、IDH1遺伝子の変異によって阻害されることを発見した。
研究者らは、異なるアミノ酸配列を持つ異なるタンパク質アイソフォームを作成する 2 つの RNA スプライシング イベントの機能を確認しました。
「これらのアイソフォームのうち、正常な脳で通常発現するもう一方のアイソフォームとは異なり、腫瘍の増殖を促進できるのは1つだけです。腫瘍はこのメカニズムを利用して、腫瘍促進アイソフォームを正常な脳のアイソフォームよりも選択的に発現させます」とソン氏は述べた。
研究チームはその後、上流のRNA結合タンパク質を解析し、PTBP1遺伝子が神経膠腫細胞における腫瘍促進性RNAスプライシングを制御していることを発見した。免疫不全マウスの同所性神経膠腫モデルを用いて、研究者らはPTBP1を標的としたアンチセンスオリゴヌクレオチド(ASO)ベースの治療を行い、最終的に腫瘍の増殖を抑制した。
「私たちのデータは、神経膠腫の悪性度と異質性に影響を及ぼす選択的RNAスプライシングの役割と、成人神経膠腫の治療における治療上の脆弱性となる可能性を強調している」と研究著者らは記している。
研究者たちの次のステップは、PTBP1を標的にして抗腫瘍免疫反応を誘発する可能性を探ることだとソン氏は語った。
「ロングリードRNAシーケンシング解析を用いて、神経膠腫細胞においてPTBP1を標的とすると、正常組織には存在しない複数の選択的スプライシング転写産物が生成されることがわかりました。そこで、私たちの次のプロジェクトは、このアイソフォームが何らかの抗原を生成し、免疫系が腫瘍をより適切に認識できるかどうかを調べることです」とソン氏は述べた。
ソン氏はまた、研究チームは神経膠腫患者の免疫細胞など、腫瘍以外の細胞におけるスプライシングの変化を分析することにも興味があると付け加えた。
スプライシングが細胞機能の調節に非常に重要であることは既に分かっています。そのため、腫瘍の悪性度を調節するだけでなく、免疫細胞の機能を調節して、がん細胞を効果的に殺傷できるかどうかを決定することもできるはずです。そこで私たちは、腫瘍に浸潤した免疫細胞を対象に、免疫細胞が腫瘍に浸潤した後にスプライシングに変化が生じるかどうかを調べるバイオインフォマティクス解析も行っています。
「私たちの目標は、免疫抑制腫瘍微小環境の形成における選択的スプライシングの役割を解明し、神経膠腫における免疫療法の有効性を改善するための潜在的な標的を特定することです」とソン氏は述べた。

