新しい出版物
近年、免疫療法はがん治療に革命をもたらしました。腫瘍を直接標的とするのではなく、患者の免疫系に腫瘍をより効果的に攻撃するよう誘導する免疫療法です。これは特に治療困難ながんに有効です。しかし、現在の免疫療法に反応を示すがん患者は全体の半数にも満たないため、どの患者が治療から最も恩恵を受ける可能性を予測できるバイオマーカーの特定が急務となっています。
最近、科学者たちは、腫瘍のARID1A遺伝子に変異がある患者は、がんと闘う免疫細胞を活性化させ続けることで効果を発揮する免疫療法の一種である免疫チェックポイント阻害薬に好反応を示す可能性が高いことに気づきました。
ARID1A遺伝子変異は、子宮内膜がん、卵巣がん、大腸がん、胃がん、肝臓がん、膵臓がんなど多くのがんに見られることから、ソーク研究所の研究者たちは、それが治療感受性にどのように影響するのか、また臨床医がこの情報をどのように利用して各患者のがん治療を個別化できるのかを疑問に思っていた。
Cell 誌に掲載された彼らの新しい研究は、ARID1A 変異が抗ウイルスのような免疫反応を通じてがんと闘う免疫細胞を腫瘍に集め、腫瘍を免疫療法に対して敏感にすることを示しています。
研究者らは、この変異と抗ウイルス免疫応答は、免疫チェックポイント阻害薬などの特定の免疫療法の適応患者をより適切に選択するためのバイオマーカーとして利用できる可能性があると示唆している。また、これらの知見は、ARID1Aおよび関連タンパク質を標的とし、他の腫瘍の免疫療法に対する感受性を高める薬剤の開発を促進するものでもある。
「これは患者さんのがん治療の成果を大きく変える可能性があります」と、本研究の筆頭著者であるダイアナ・ハーグリーブス准教授は述べています。「ARID1A変異を持つ患者さんは既に免疫反応を起こしています。ですから、私たちがすべきことは、免疫チェックポイント阻害薬によってその反応を増強し、腫瘍を内側から破壊できるようにすることです。」
ARID1A変異を持つ人は免疫チェックポイント阻害薬によく反応することが知られていましたが、両者の正確な関連性は依然として不明でした。このメカニズムを解明するために、ソーク研究所の研究者たちは、ARID1A変異と機能的ARID1Aの両方を持つメラノーマと大腸がんのマウスモデルを用いました。
出典:Cell (2024). DOI: 10.1016/j.cell.2024.04.025
研究チームは、ARID1A変異を持つすべてのモデルにおいて強力な免疫反応を観察しましたが、ARID1Aが機能しているモデルでは反応が見られませんでした。これは、ARID1A変異が実際にこの反応を引き起こしているという考えを裏付けています。しかし、これは分子レベルでどのように機能するのでしょうか?
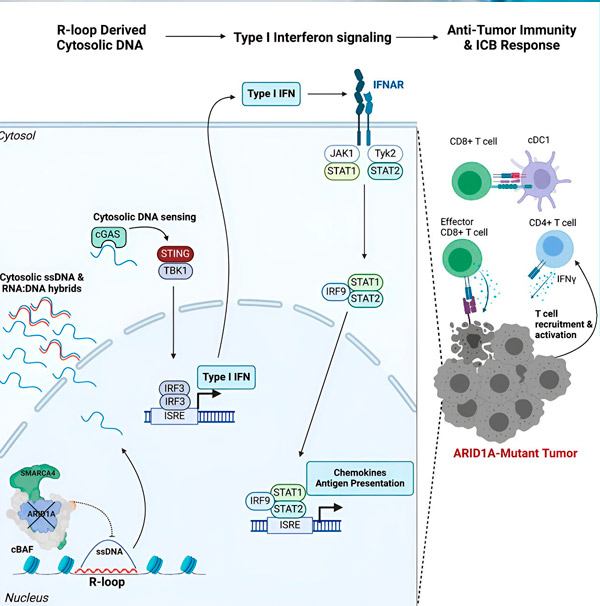
「ARID1Aは核内で適切なDNA構成を維持することで重要な役割を果たしていることを発見しました」と、本研究の筆頭著者であり、ハーグリーブス研究室の大学院生であるマシュー・マクスウェル氏は述べています。「機能的なARID1Aがなければ、遊離DNAが切除されて細胞質へ放出され、免疫チェックポイント阻害によって増強される可能性のある、望ましい抗ウイルス免疫反応が活性化されます。」
ARID1A遺伝子は、DNAの形状を制御し、ゲノムの安定性を維持するタンパク質をコードしています。ARID1Aが変異すると、がん細胞においてルーブ・ゴールドバーグのような一連の出来事を引き起こします。
まず、機能的なARID1Aの欠損により、DNAが細胞質へ放出されます。細胞質DNAは、ウイルス感染から身を守るために細胞質内のあらゆるDNAを異物と認識するように適応しているため、抗ウイルス警報システムであるcGAS-STING経路を活性化します。最終的に、cGAS-STING経路は免疫系を活性化し、腫瘍にT細胞を誘導して、それらをがん特化型のキラーT細胞へと活性化します。
各ステップにおいて、ARID1A変異、DNAエスケープ、cGAS-STING警報、T細胞リクルートメントという一連のイベントが、前のステップに依存しながら、腫瘍内のがんと闘うT細胞数の増加につながります。免疫チェックポイント阻害薬を用いることで、これらのT細胞が活性化された状態を維持し、がんを撃退する能力を高めることができます。
「私たちの研究結果は、ARID1A変異が抗腫瘍免疫応答に寄与する可能性のある新たな分子メカニズムを示しています」とハーグリーブス氏は述べている。「これらの研究結果の注目すべき点は、その応用可能性です。ARID1A変異を用いて免疫チェックポイント阻害薬の投与対象となる患者を選択できるだけでなく、ARID1Aまたはそのタンパク質複合体を阻害する薬剤が、他の患者における免疫療法の効果をさらに高めるメカニズムも明らかになりました。」
ARID1A変異を有するがんにおいて免疫チェックポイント阻害薬がより効果的となるメカニズムを明らかにすることで、研究者らは、ARID1A変異を有する患者に対し、この免疫療法を優先すべき根拠を臨床医に提供します。これらの知見は、がん治療の個別化に向けた重要な一歩であり、ARID1Aとそのタンパク質複合体を標的とする新たな治療法の開発を刺激するものです。
今後、ソーク研究所のチームは、その研究結果によって、ARID1A変異に関連するさまざまな種類の癌患者の治療成績が改善されることを期待しており、カリフォルニア大学サンディエゴ校と協力してこの臨床応用を探求するつもりです。

