新しい出版物
東京医科歯科大学(TMDU)の研究者らは、歯周炎の進行を経時的に詳細に分析できる技術を開発した。
歯周病(歯周炎)は、歯を失う主な原因であり、世界中で成人の約5人に1人が罹患しています。ほとんどの場合、この症状は歯周組織の細菌感染に対する炎症反応によって引き起こされます。
症状が悪化すると、歯茎が後退し始め、歯根と骨が露出します。特に、歯周炎の発症率は加齢とともに増加します。世界人口の寿命が延びている今、歯周炎の根本的な原因と進行過程をしっかりと理解することが重要です。
Nature Communications 誌に掲載された研究で、TMDU の研究者らは、歯周炎の研究に広く使用されている動物モデルを改良することでこの目標を達成する方法を発見しました。
ヒトにおける歯周炎を直接研究することは困難です。そのため、科学者は前臨床研究においてしばしば動物モデルに頼ります。例えば、「結紮誘発性歯周炎マウスモデル」は、2012年の導入以来、研究者が歯周炎の根底にある細胞メカニズムを研究することを可能にしてきました。
簡単に言えば、このモデルはマウスの臼歯に絹糸を置き、歯垢を蓄積させることで人工的に歯周病を誘発するものです。この方法は簡便で効果的ですが、歯周炎の全体像を捉えているわけではありません。
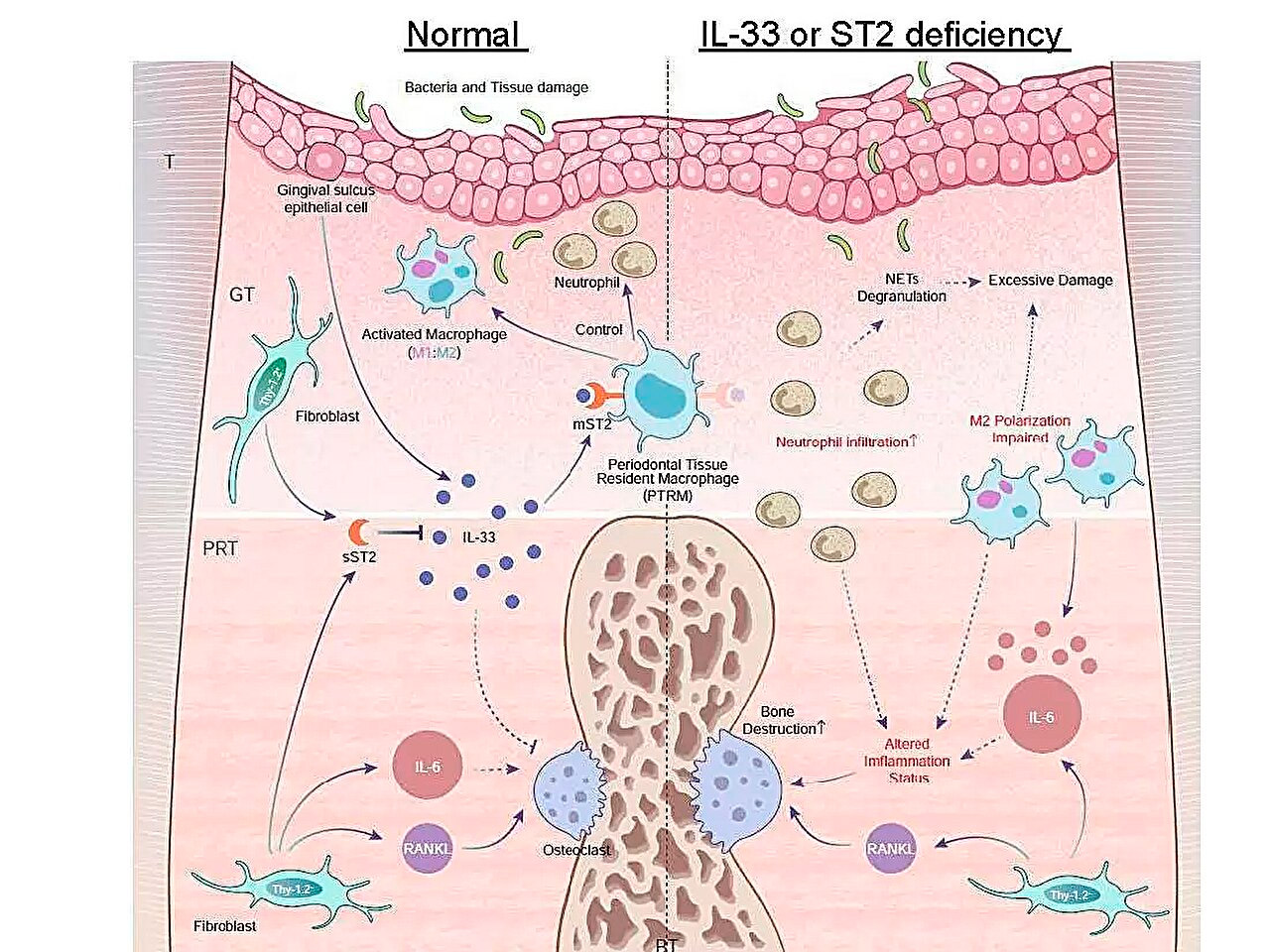
歯周炎における炎症性遺伝子発現プロファイルと、急性炎症に対するIL-33/ST2軸の役割を示す模式図。出典:東京医科歯科大学。
「歯周組織は歯肉、歯周靭帯、歯槽骨、セメント質で構成されていますが、技術的および定量的な制約のため、通常は歯肉サンプルのみの分析が行われています」と、筆頭著者のアンハオ・リウ氏は指摘する。「このサンプル採取戦略では、これらの研究から得られる結論が制限されるため、すべての組織成分を同時に分析できる手法が必要です。」
この限界に対処するため、研究チームは改良型結紮誘発性歯周炎モデルを開発しました。従来の単結紮ではなく、雄マウスの左上臼歯に三重結紮を施しました。この戦略により、第二臼歯周囲の骨を著しく破壊することなく骨吸収領域を拡大し、歯周組織の多様性を高めることができました。
「私たちは3つの主要な組織タイプを分離し、2つのモデル間のRNA収量を評価しました。その結果、三重結紮モデルは収量を効果的に増加させ、正常な歯根周囲組織の4倍の量を達成し、異なる組織タイプの高解像度分析をサポートすることが示されました」と、筆頭著者の林幹人博士は説明しています。
研究者らは、改良モデルの有効性を確認した後、炎症と破骨細胞の分化に関連する遺伝子に焦点を当て、時間の経過とともにさまざまな組織タイプにおける遺伝子発現に対する歯周炎の影響を研究することに着手しました。
重要な発見の一つは、結紮後5日目に歯根周囲組織におけるIl1rl1遺伝子の発現が有意に上昇していたことです。この遺伝子は、受容体型およびデコイ型のST2タンパク質をコードしており、炎症および免疫調節プロセスに関与するIL-33と呼ばれるサイトカインと結合します。
この遺伝子の役割について更なる知見を得るため、研究チームはIl1rl1遺伝子またはIl33遺伝子のいずれかを欠損した遺伝子改変マウスに歯周炎を誘発させた。これらのマウスでは炎症性骨破壊が加速し、IL-33/ST2経路の保護的役割が強調された。ST2タンパク質の受容体型であるmST2を含む細胞をさらに解析したところ、そのほとんどがマクロファージに由来することが明らかになった。
「マクロファージは、その活性化の程度によって、炎症誘発性と抗炎症性の2つの主要なタイプに分類されます。mST2発現細胞は、両タイプのマクロファージのマーカーを同時に発現するという点で独特であることがわかりました」と、本研究の主任著者である岩田隆則博士は述べています。「これらの細胞は炎症が始まる前から歯根周囲組織に存在していたため、『歯周組織常在マクロファージ』と名付けました。」
総合すると、この研究の結果は、改良された動物モデルが、生体分子レベルに至るまでより詳細な規模で歯周炎を研究する力を持っていることを示しています。
「歯周病における炎症と骨破壊を制御する新たなIL-33/ST2分子経路、そして歯周病に深く関与する歯根周囲組織の特異的マクロファージの可能性を示唆しています。この発見が、新たな治療法や予防法の開発につながることを期待しています」と、筆頭著者の中島智樹博士は結論づけています。

