新しい出版物
テキサス大学サウスウェスタン医療センターの研究者らは、B細胞中のミドノリンと呼ばれるタンパク質を完全に、あるいは部分的に減少させることで、遺伝的にこれらの癌になりやすいマウスモデルにおいて白血病とリンパ腫を抑制することに成功した。
実験医学ジャーナルに掲載された彼らの研究結果は、現在の治療法の深刻な副作用を回避するこれらの疾患の新たな治療法につながる可能性がある。
「私たちは、薬剤ターゲットを見つけるために純粋に遺伝学的アプローチを採用しました。このターゲットは、B細胞白血病とリンパ腫がこれに大きく依存しているのに対し、ほとんどの宿主組織は依存していないため、非常に画期的でした」と、研究リーダーでテキサス大学サウスウェスタン医療センターの遺伝子宿主防御センター所長、免疫学および内科教授のブルース・ビュートラー医学博士は述べた。
2011年に免疫細胞に存在するToll様受容体として知られる重要な病原体センサー群を発見したことでノーベル生理学・医学賞を受賞したビュートラー博士は、長年にわたり、突然変異誘発(N-エチル-N-ニトロソ尿素(ENU)と呼ばれる化学物質にさらすことで動物モデルの遺伝子に突然変異を導入する)を遺伝子機能の研究における重要なツールとして利用してきた。
最近、ビュートラー氏の研究室は、自動減数分裂マッピング(AMM)と呼ばれる手法を開発しました。これは、突然変異マウスの異常な特徴を原因となる突然変異まで追跡し、正常な生理学的状態を維持するために必要な遺伝子を特定するものです。
突然変異は動物に遺伝性疾患を引き起こすことが多く、動物における異常を研究することで、影響を受けた遺伝子の機能に関する知見が得られます。しかし、ビュートラー博士が説明したように、突然変異は疾患に対する防御機能も果たします。
例としては、HIVや遺伝性鎌状赤血球症の患者を症状の発現から守る変異が挙げられます。一部の保護的変異の根底にあるメカニズムは、様々な疾患の治療薬の開発につながっています。
免疫疾患の予防につながる変異を探索するため、研究者らは変異マウスをスクリーニングし、異常な特徴を持つ免疫細胞を探索した。抗体産生を担う適応免疫系の重要な構成要素であるB細胞の数が異常に少ないマウス群において、研究者らはAMMを用いて、その欠損の原因を主にB細胞に存在するタンパク質であるミドノリンの変異にまで遡った。
ミドノリンを完全に欠く動物は出生前の発育中に死亡するが、成体になってから遺伝子を消去できる遺伝子技術を通じてもたらされる突然変異など、軽度の突然変異は明らかな害を及ぼさない。
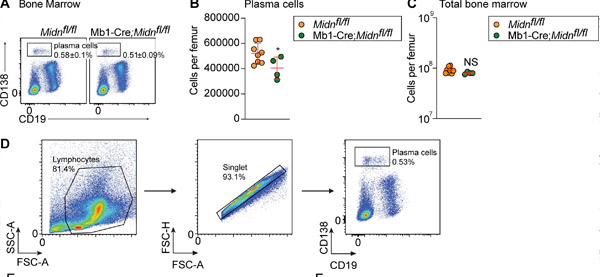
Mb1-Cre;Midn fl/flマウスにおけるTD抗原β-ガラクトシダーゼ免疫後の形質細胞産生。(AおよびB) β-ガラクトシダーゼ免疫後の8週齢Mb1-Cre;Midn fl/flマウスおよびMidn fl/flマウスの骨髄における形質細胞の代表的なフローサイトメトリーグラフ(A)および数(B)。(C) 大腿骨あたりの総骨髄細胞数。(D) 形質細胞分離戦略。出典:Journal of Experimental Medicine (2024). DOI: 10.1084/jem.20232132
研究者らは、B細胞白血病およびリンパ腫(B細胞が制御不能に分裂する癌)の遺伝的素因を持つマウスにおいて、ミドノリンを著しく減少または消失させた。ミドノリン値が正常のマウスは5ヶ月以内にこれらの疾患で死亡したが、ミドノリン値が低かった、または全くなかったマウスのほとんどは悪性腫瘍を発症しなかった。
追加の実験により、ミドノリンのB細胞における役割は、損傷したタンパク質や不要になったタンパク質を除去する細胞小器官であるプロテアソームの活性を刺激することであることが示されました。現在、B細胞性白血病やリンパ腫の治療に用いられているいくつかの治療法は、ミドノリンを除去するのと同様に、プロテアソームの活性を阻害することで作用すると、ビュートラー博士は説明しました。
しかし、多くの潜在的に深刻な副作用を伴うこれらの薬剤とは異なり、動物モデルではミドノリンを排除または減量しても悪影響はないようです。
今後の研究は、ミドノリンを阻害する薬剤の開発に重点が置かれ、最終的にはB細胞がんの新たな治療法の基礎となる可能性があります。

