新しい出版物
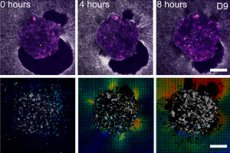
バルセロナ(IBEC、Dexeus Mujer)とテルアビブの研究者らは、ヒト胚が「子宮の足場」に付着し、文字通り周囲の組織を引っ張って再構築する様子を、初めてリアルタイムかつ3Dで実証しました。この実験では、変形可能な体外プラットフォーム(コラーゲン/ECMゲル)を作成し、生きたヒトおよびマウスの胚に直接牽引力顕微鏡を適用しました。重要な発見は、力のパターンが種特異的であること、そして胚自体が機械感受性を持っていることです。胚は外部からの機械的刺激に反応し、細胞骨格を再構築し、成長方向を変化させます。
研究の背景
着床はヒト生殖の「ボトルネック」であり、自然妊娠と体外受精の両方において、最も頻繁に失敗するのはこの段階です。同時に、ヒトの着床は組織間性です。つまり、胚は単に「接着」するのではなく、子宮内膜に完全に埋め込まれます。これは生化学的かつ機械的に複雑なプロセスですが、最近までヒトの生体システムではほとんど観察されていませんでした。そのため、接着と侵入のメカニズムは「ブラックボックス」のままであり、結論は間接的なマーカーや動物モデルのデータに基づいて導き出されることがよくありました。
古典的な着床生物学はマウスに大きく依存してきましたが、胚盤胞の向きから着床の深さ、細胞間の力のパターンに至るまで、種間には根本的な違いがあります。マウスでは着床はより「表層的」で、組織の変位方向が優先されます。一方、ヒトでは着床は明らかに侵襲的で、胚の周囲に多点的な牽引力が働きます。これらの違いは、特に力学的な面において、マウスモデルが必ずしもヒトに当てはまるわけではないことを示唆しています。変形可能な環境におけるヒト胚の直接観察が必要でした。
この技術的ブレークスルーは、変形可能な2D/3Dマトリックス(コラーゲン/細胞外マトリックス)と牽引力顕微鏡を、長時間の高周波イメージングと組み合わせることで実現しました。この「人工子宮」により、胚が周囲の組織をどのように引っ張り、再構築し、「穿孔」するか、そして外部からの機械的刺激(機械感受性)にどのように反応するかを、文字通り観察・測定することが可能になりました。これにより、着床可能性を評価するための新たな基準や、胚移植条件の微調整への道が開かれます。
文脈は次のように適用されます。環境の機械的特性と胚の力のパターンが着床の成功と関連している場合、体外受精において、基質の剛性/組成を意図的に選択し、移植の時期を考慮し、「力」指標を追加の選択マーカーとして使用することさえ可能です。同時に、このようなプラットフォームは、生化学的性質は「正常」であるものの、接着のメカニズムが正常ではない場合の早期妊娠喪失の割合を説明するのに役立ちます。これらすべてにより、ヒト着床の直接的な3D観察は、単なる美しい映像ではなく、生殖医療のための新たなツールとなります。
なぜこれが重要なのでしょうか?
着床不全は不妊症の主な原因の一つであり、自然流産の最大60%を占めています。体外受精における生化学的進歩にもかかわらず、ヒトにおけるこの過程のメカニズムは依然として「ブラックボックス」のままでした。新たなアプローチにより、胚着床の力と軌道を観察できるようになり、胚の選択と移植条件の改善のための基盤が提供されます。
どのように行われたか
研究者たちは「人工子宮」を組み立てた。これは柔らかく透明で変形可能な環境であり、その中で組織のような基質が胚の力の影響を受けて目に見える形で変化する。次に、繊維の変位を連続的に顕微鏡観察し、コンピューター解析を行った。
- 2D および 3D プラットフォーム: 3D では、胚はすぐにマトリックスに埋め込まれます (付着段階は「バイパス」されます)。これにより、組織の厚さへの掘削を確認できます。
- 3D での高い「生存率と侵入率」: 侵入成功率は約 80% (ガラスへの近さによって制限されます)。
- トラクション マップとデジタル ボリューム相関は、胚の周囲の変位の振幅と方向を示します。これは本質的に、時間の経過に伴う力の「プリント」です。
何が発見されたのか(簡潔に、要点ごとに)
1) 種特異的な着床メカニズム
- ヒト: 胚がマトリックスに挿入され、複数の牽引焦点が形成され、胚の周囲に放射状に均一な変位が形成されます。侵入の深さは最大 200 µm です。
- マウス: 胚は主に表面上に広がり、主な移動方向が明確に定まります。
2) 胚は環境の仕組みを感知する
- 外力 → 答え: ヒトの胚ではミオシンの動員と方向付けられた細胞仮足、マウスでは外力の発生源に向かう着床/成長軸の回転 (PD 軸の向き)。
- 機械感受性マーカー: マウスでは栄養芽細胞における YAP の局在が変化します。これらを合わせると、機械感受性フィードバック回路が示されます。
3) 強度と移植成功の関係
- コラーゲンの変位が少ない → ヒト胚の着床の進行が悪くなる。
- インテグリン - 強さの「カップラー」: マウスにおける RGD ペプチド遮断/Src 阻害により、移植の深さ/面積が減少します。
実装はどのようになりますか?
- 2D および 3D プラットフォームでは、胚の周囲に繊維変位の「ハロー」が拡大し、牽引マップは、あたかも胚が周囲を「スキャン」しているかのように脈動します。
- ガラス上では、人間の胚は平らな突起を形成しますが、柔らかいマトリックス内では、生体組織のように、より球形のまま深く成長します。
これは実践に何をもたらすのか(体外受精の見通しだけでなく)
考え方はシンプルです。移植は「受容体の化学反応」だけでなく、接着と牽引のメカニズムも考慮する必要があります。つまり、以下の点を最適化できるのです。
- 培養/移植電位試験中の材料および培地硬度。
- 胚選択のための新しいマーカー - 「スマート」マトリックス内の変位の軌跡と振幅に基づく。
- 積極的な介入なしで癒着を改善するための子宮トレーニング/調整(穏やかな機械的刺激によるものなど)。
注意:体外受精は「子宮内」で行うものではありません。しかし、外部からの機械的シグナルによって着床の方向や軸の配置が変化するという事実自体が、個々の状況に合わせた胚移植への道を開きます。
制限
- ex vivo モデルでは、実際の子宮内膜の免疫、ホルモン、血管の動態は考慮されません。
- マトリゲル/コラーゲンは一連の特性(剛性、粘弾性、組成)を定義しており、1 つのパラメータでそれらを変更するのは困難です。
- ヒト研究(最長14日間)における倫理的制約により、長期観察は制限されます。しかしながら、既知の生体内移植形態(ヒトでは組織内、マウスでは表層)との高い一致率により、このモデルの信頼性は高まります。
結論
ヒト胚は母体組織に積極的に「引っ張り」「穿孔」し、環境からの力学的な刺激によってその行動が再構成されます。ヒトとマウスでは、力のパターンと着床戦略が異なります。これが、マウスモデルがヒトの着床成功を必ずしも予測できない理由を説明できるかもしれません。力学は、現在、初期発生学および生殖医療において本格的な役割を果たしています。
出典:Godeau AL et al.牽引力と機械感受性がヒトおよびマウス胚における種特異的な着床パターンを媒介する. Science Advances 11(33): eadr5199 (2025年8月15日). DOI: 10.1126/sciadv.adr519

