新しい出版物
イェール大学の科学者による新たな研究では、新たな化合物が周囲の健康な組織を傷つけずに薬剤耐性脳腫瘍を攻撃する仕組みが説明されている。
アメリカ化学会誌に掲載されたこの研究は、さまざまな危険な癌と闘うために使用できる、いわゆる「カメレオン化合物」の開発における重要な一歩である。
神経膠腫は、毎年10万人あたり約6.6人の割合で発症し、14歳までに10万人あたり2.94人の割合で発症します。中枢神経系に達する他の癌の転移を除くと、神経膠腫はすべての脳腫瘍(原発性脳腫瘍)の26%、すべての悪性脳腫瘍の81%を占めます。
数十年にわたり、膠芽腫の患者はテモゾロミドという薬剤で治療されてきました。しかし、ほとんどの患者は1年以内にテモゾロミド耐性を発現します。膠芽腫の患者の5年生存率は5%未満です。
2022年、イェール大学の化学者セス・ハーゾン氏と放射線腫瘍医ランジット・ビンドラ博士は、膠芽腫をより効果的に治療するための新たな戦略を開発しました。彼らは、O6-メチルグアニンDNAメチルトランスフェラーゼ(MGMT)と呼ばれるDNA修復タンパク質の欠陥を利用する、カメレオン化合物と呼ばれる抗がん分子群を創製しました。
神経膠芽腫を含む多くの癌細胞はMGMTタンパク質を欠損しています。新たなカメレオン化合物は、MGMTを欠損する腫瘍細胞のDNAに損傷を与えるように設計されています。
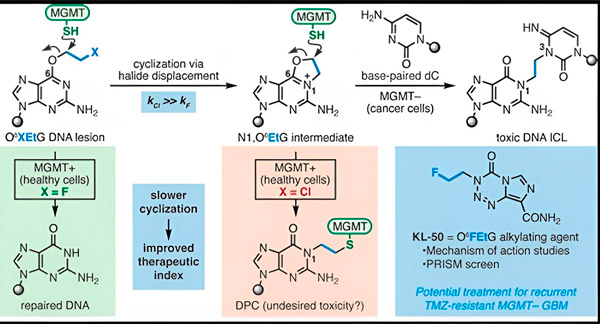
カメレオン化合物はDNAに一次損傷を沈着させることでDNA損傷を引き起こし、時間の経過とともに、鎖間架橋と呼ばれる非常に毒性の高い二次損傷へと進化します。MGMTは、一次損傷が致命的な鎖間架橋へと進化する前に修復することで、健康な組織のDNAを保護します。
新しい研究では、共著者のヘルゾン氏とビンドラ氏は、先導カメレオンであるKL-50に焦点を当てた。
「合成化学と分子生物学の研究を組み合わせ、これまでの観察結果の分子基盤と、これらの化合物の独自の選択性をもたらす化学反応速度論を解明しました」と、イェール大学ミルトン・ハリス化学教授のハーゾン氏は述べています。「KL-50は、DNA修復に欠陥のある腫瘍においてのみDNA架橋を形成するという点で独特であり、健康な組織には影響を与えないことを示しました。」
出典:アメリカ化学会誌(2024年)DOI: 10.1021/jacs.3c06483
これは大きな違いだと研究者たちは指摘する。これまでにも多くの抗がん剤が鎖間架橋を誘導するように設計されてきたが、それらは腫瘍細胞に対して選択的ではなく、その有用性は限られている。
KL-50の成功の秘訣はそのタイミングにあると研究者らは指摘する。KL-50は他の架橋剤よりもゆっくりと鎖間架橋を形成する。この遅延により、健康な細胞はMGMTを利用して架橋の形成を防ぐのに十分な時間を持つ。
「このユニークなプロファイルは、薬剤耐性膠芽腫の治療に可能性を示唆しています。この分野は臨床において大きなアンメットニーズを抱えています」と、イェール大学医学部のハーベイ・アンド・ケイト・クッシング放射線治療学教授であるビンドラ氏は述べています。ビンドラ氏は、スミロ病院のシェネバート・ファミリー脳腫瘍センターの科学ディレクターも務めています。
ヘルゾン氏とビンドラ氏は、今回の研究は化学的DNA修飾と生化学的DNA修復の速度を考慮することの重要性を浮き彫りにしたと述べています。彼らは、この戦略を用いることで、腫瘍に関連する特定のDNA修復欠陥を有する他のがんの治療法開発に活用できると考えています。

