ケルン大学CECAD老化研究エクセレンスクラスターの小田博嗣博士率いる研究チームは、特定のタンパク質複合体がいくつかの免疫調節異常において果たす役割を発見しました。この研究成果は、このタンパク質複合体の遺伝的機能不全に苦しむ患者の自己膨張を軽減し、免疫システムを「回復」させることを目的とした新たな治療法の開発につながる可能性があります。
「二対立遺伝子型ヒトSHARPINの機能喪失は自己炎症と免疫不全を誘発する」という研究は、Nature Immunology誌に掲載されました。
HOIP、HOIL-1、そしてSHARPINというタンパク質から構成される直鎖状ユビキチン集合複合体(LUBAC)は、免疫恒常性の維持において重要な役割を果たすことが長年認識されてきました。マウスを用いた過去の研究では、SHARPINの欠損が深刻な結果をもたらし、過剰な皮膚細胞死による重篤な皮膚炎を引き起こすことが示されています。しかし、ヒトにおけるSHARPIN欠損の具体的な健康への影響は未だ解明されていません。
研究チームは、自己膨張と免疫不全の症状を示すものの、意外にもマウスの場合のような皮膚科的問題は示さないSHARPIN欠損症患者2名を初めて報告した。
さらなる調査の結果、これらの患者は重要な免疫応答経路である標準的なNF-κB応答に障害があることが判明しました。また、腫瘍壊死因子(TNF)スーパーファミリーのメンバーによって誘導される細胞死に対する感受性が高まっていました。SHARPIN欠損患者1名に対し、TNF誘導性細胞死を特異的に阻害する抗TNF療法を施行したところ、細胞レベルおよび臨床症状における自己膨張が完全に消失しました。
この研究は、過剰かつ制御不能な細胞死がヒトの遺伝性炎症性疾患において重要な役割を果たしていることを示しています。小田教授らは、SHARPIN欠損症を、彼らが「先天性細胞死異常」と呼ぶヒトの遺伝性炎症性疾患群の新たなメンバーとして加えました。
免疫調節異常に対する防御 この研究は、米国国立衛生研究所(NIH)のダン・カストナー博士の研究室で開始されました。研究者たちは、幼少期に原因不明の発熱、関節炎、大腸炎、免疫不全を発症した患者を観察する機会を得ました。
インフォームドコンセントを得た後、研究チームは患者とその家族を対象にエクソームシークエンシングを実施し、患者はSHARPIN遺伝子に深刻な遺伝子変異を有しており、その結果SHARPINタンパク質が検出限界以下になっていることを明らかにしました。また、培養細胞と生検の両方において、患者の細胞が死滅する傾向が高まっていることも判明しました。
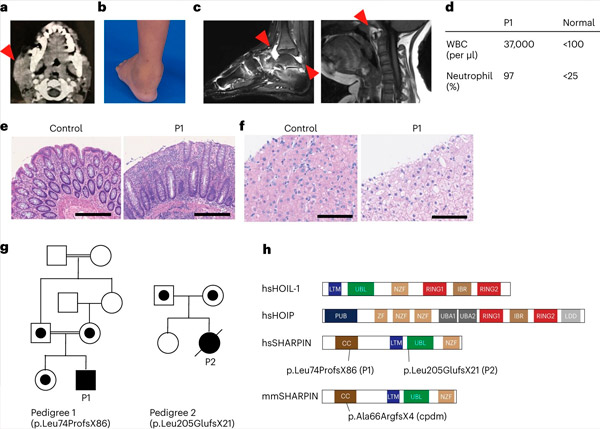
ヒトにおけるSHARPIN欠損は自己炎症および肝グリコーゲン症を引き起こす。出典:Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
研究チームはまた、アデノイド内の特殊な微細構造であるリンパ胚中心の発達が、B細胞死の増加によって著しく低下していることも発見しました。リンパ胚中心は、免疫系のB細胞の成熟、ひいては抗体産生に不可欠な役割を果たします。これらの知見は、患者の免疫不全を説明するものであり、ヒトにおける免疫恒常性の維持におけるLUBACの重要な役割を浮き彫りにしています。
「本研究は、免疫調節異常の予防におけるLUBACの重要性を浮き彫りにしました。LUBAC欠乏症の根底にある分子メカニズムを解明することで、免疫恒常性の回復を目指した新たな治療戦略への道が開かれます」と、本研究の筆頭著者である小田氏は述べています。
彼はさらにこう付け加えた。「シャーピン欠損症の患者さんの一人は、私たちが初めて診察する以前から何年も車椅子生活を送っていました。足首は炎症を起こしており、歩くのも苦痛でした。遺伝子診断によって、彼の症状の根底にある分子経路を正確に特定することができました。」
患者さんはTNF阻害薬の投与を開始して以来、7年近く症状が改善しています。「臨床医として、そして科学者として、私たちの研究を通して患者さんの人生に良い影響を与える機会を得られたことを嬉しく思います」と小田氏は締めくくりました。

