新しい出版物

Nature Medicine誌に最近発表された研究で、科学者らはランダム化二重盲検プラセボ対照第2a相試験を実施し、p75神経栄養因子受容体(p75NTR)の調節を通じてアルツハイマー病(AD)の治療におけるLM11A-31の安全性と有効性を調べました。
晩発性アルツハイマー病(AD)は最も一般的な認知症であり、シナプス障害、神経細胞の変性、および喪失を特徴とします。AD治療における主要な2つの薬剤は、異常なアミロイドβタンパク質またはタウタンパク質の蓄積を標的としていますが、病態生理の一部にしか対処していません。別のアプローチでは、基本的な生物学的経路に影響を及ぼす受容体とシグナル伝達ネットワークを標的とします。前臨床研究では、新規低分子化合物LM11A-31を用いたp75NTRの調節が、アミロイドおよび異常なタウタンパク質によるシナプス喪失を軽減することが示されています。
研究の説明
このランダム化臨床試験で、研究者らは、LM11A-31 が人間の p75NTR を調節することでアルツハイマー病の進行を遅らせることができるかどうかを調査しました。
軽度から中等度の喘息患者242名を対象に、LM11A-31経口カプセル(200 mgおよび400 mg)またはプラセボを1:1:1の比率で26週間投与しました。被験者は、マッカーン基準に基づき生物学的にアルツハイマー病(脳脊髄液アミロイドβタンパク質42(Aβ42)濃度が550 ng/L未満またはAβ42:β40比が0.89未満)と診断され、ミニ精神医学検査(MMSE)スコアが18~26、老年期うつ病評価尺度(GDS)スコアが5.0未満、修正ハチンスキー虚血性尺度(HIS)スコアが4.0以下、正規教育歴が8年以上、認知機能低下歴が6ヶ月以上であることが確認されていました。
適格な参加者は、研究参加前3ヶ月以上、アセチルコリンエステラーゼ阻害薬(AChEI)または部分NMDA受容体拮抗薬を服用していた。抗精神病薬、ベンゾジアゼピン系薬剤、抗てんかん薬、鎮静剤、中枢作用型降圧薬、向知性薬(イチョウ葉を除く)、オピオイド含有鎮痛剤などの違法薬物は服用していなかった。
本研究の主要評価項目は安全性と忍容性であり、コロンビア自殺念慮・行動重症度評価尺度(C-SSRS)、バイタルサイン、血圧、血液学的パラメータを用いて評価しました。副次的認知アウトカムの評価には、構造磁気共鳴画像法(cMRI)、フルオロデオキシグルコース陽電子放出断層撮影(FDG-PET)、および脳脊髄液(CSF)バイオマーカーを使用しました。ADの指標には、Thr181リン酸化タウ、総タウタンパク質、Aβ40、Aβ42、およびAChE活性が含まれました。研究チームは、ベースライン、12週目、および26週目に、カスタマイズされた神経心理学的検査を用いて副次的認知アウトカムを評価しました。
研究結果
本試験では、LM11A-31は安全かつ忍容性に優れており、重大な安全性上の懸念は認められませんでした。最も多く認められた有害事象は、頭痛、下痢、好酸球増多、鼻咽頭炎であり、胃腸障害と好酸球増多が投与中止の主な理由でした。400mg群では、200mg群およびプラセボ群と比較して、投与中止例が多く見られました。MRI検査では、アミロイド関連異常を含め、安全性上の懸念は認められませんでした。両治療群間で、認知機能スコアおよびアミロイド異常に有意差は認められませんでした。
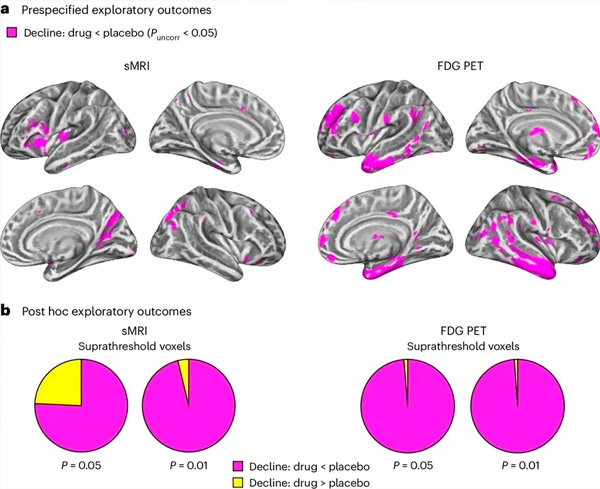
A. 二元配置混合モデルによる共分散分析では、治療(薬物またはプラセボ)と時間(治療前または治療後)の相互作用を調べました。相互作用仮説(薬物はプラセボと比較して進行を遅らせる)を調べる片側t対比では、LM11A-31治療により、プラセボ群(cMRI、n = 66、PET、n = 62)と比較して、薬物群(cMRI、n = 127、PET、n = 121)で縦方向変性(左パネル)とグルコース代謝低下(右パネル)が遅くなることが示されました。この相互作用を示すボクセルは、集団特異的な皮質表面上でP < 0.05(マゼンタ)の未補正閾値で示されています。左半球と右半球は、それぞれ上段と下段に示されています。仮説と一致しない相互作用を示す脳領域は、補足データの図7に示されています。
B. 事前に定義された脆弱なAD脳領域(円グラフの総面積)における、仮説に一致する相互作用(マゼンタ)または仮説に反する相互作用(黄色)を示すボクセルの総数。各画像診断法(cMRI、左パネル、FDG PET、右パネル)において、未補正P < 0.01およびP < 0.05という徐々に緩い閾値で測定。モンテカルロシミュレーションの結果、仮説に一致する効果を示すボクセルと仮説に反する効果を示すボクセルの比率は、cMRIとPETの両方でランダムに生成されたデータに基づいて観察された比率よりも有意に高いことが示された(各画像診断法でP < 0.001、両側検定)。
LM11A-31は、プラセボ群と比較して、脳脊髄液(CSF)中のAβ42およびAβ40の増加を効果的に抑制しました。また、シナプス前タンパク質バイオマーカーSNAP25の年間変化率の中央値の低下とシナプス後タンパク質バイオマーカーNGの減少も示され、シナプス前およびシナプス後結合の消失が遅くなることを示唆しています。LM11A-31はYKL40の増加も抑制し、MMSEスコアの低下とADAS-Cog-13スコアの上昇をもたらしました。さらに、前頭葉および後頭頂葉における灰白質の減少、嗅内皮質、側頭葉皮質、海馬、島皮質、前頭前皮質などの領域における糖代謝の低下も抑制しました。
結論
本研究では、LM11A-31によるp75NTRの調節はより大規模な臨床試験に適していると結論付けられました。LM11A-31は主要安全性評価項目を達成し、軽度から重度のAD患者において良好な忍容性を示しました。これらの結果は、ADにおける疾患修飾療法としてp75NTRを調節する低分子化合物の可能性を評価するために、より長期の治療期間を伴う更なる研究の必要性を示唆しています。本研究では、LM11A-31がAβ40、Aβ42、SNAP25、NG、YKL40を含む複数のバイオマーカーに有意な影響を与え、病理学的進行の遅延を示唆しました。今後の研究では、グリア細胞の健康状態に関する更なる指標を評価することが期待されます。

