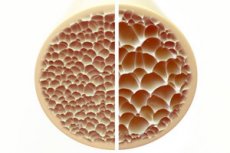
骨粗鬆症は、骨が多孔質で脆くなる症状で、骨格の健康に大きな脅威をもたらします。骨は人体の主要な構造的支持部であり、重要な支持を提供します。骨量が減少すると、この支持が損なわれるだけでなく、全体的な機能も損なわれ、生活の質が低下します。
高齢化社会で骨粗鬆症の発生率が増加するにつれて、長期ケアのための医療資源への負担が増加します。したがって、骨粗鬆症の発症に寄与するメカニズムを理解し、その長期的な影響を最小限に抑えるための効果的な標的治療を開発する必要があります。
骨芽細胞と破骨細胞は、骨組織の維持とリモデリングに重要な役割を果たす2種類の細胞です。骨芽細胞は骨形成細胞であり、新しい骨組織の合成と堆積を担う一方、破骨細胞は骨分解細胞であり、古くなった骨組織や損傷した骨組織の分解と除去に関与します。
破骨細胞の割合が増加すると、骨粗鬆症、関節リウマチ(関節の炎症)、骨転移(骨に転移した癌)などの症状で骨量が減少します。破骨細胞は、免疫細胞の一種であるマクロファージまたは単球の分化によって生じます。
したがって、破骨細胞の分化を阻害することは、骨量減少を防ぐ治療戦略となる可能性があります。しかし、骨のリモデリングの複雑なプロセスを制御する正確な分子メカニズムは不明のままです。
新しい研究では、東京理科大学の早田忠義教授、今野卓人氏、村地瞳氏が同僚と共同で、破骨細胞分化の分子制御についてさらに詳しく調べました。受容体核因子κB活性化リガンド(RANKL)による刺激は、マクロファージの破骨細胞への分化を誘導します。
さらに、骨形成タンパク質(BMP)と形質転換成長因子(TGF)-βシグナル伝達経路が、RANKLを介した破骨細胞分化の制御に関与していることが示唆されています。今回の研究では、研究者らは、BMP および TGF-β シグナル伝達経路を抑制すると報告されているホスファターゼ (リン酸基を除去する酵素) である Ctdnep1 の役割を調べようとしました。
この研究は、ジャーナル Biochemical and Biophysical Research Communications に掲載されました。
早田教授は次のように述べています。「RANKL は破骨細胞分化の「アクセル」として機能します。車を運転するには、アクセルだけでなくブレーキも必要です。ここで、Ctdnep1 が破骨細胞分化の「ブレーキ」として機能することがわかりました。」
研究者らはまず、RANKL を投与したマウスのマクロファージと、投与していない対照細胞における Ctdnep1 の発現を調べました。研究者らは、Ctdnep1 の発現が RANKL 刺激に反応して変化しなかったことを指摘しました。しかし、マクロファージでは顆粒状の形で細胞質に局在し、破骨細胞に分化しました。これは、他の細胞種での通常の核周囲局在とは異なり、破骨細胞分化における細胞質機能を示しています。
さらに、Ctdnep1 ノックアウト (遺伝子のダウンレギュレーション) により、酒石酸耐性酸性ホスファターゼ (TRAP) 陽性の破骨細胞の数が増加しました。TRAP は分化した破骨細胞のマーカーです。
Ctdnep1 ノックアウトにより、RANKL によって破骨細胞分化に誘導されるマスター転写因子「Nfatc1」を含む主要な分化マーカーの発現が増加しました。これらの結果は、Ctdnep1 の「阻害機能」を裏付けており、それによって Ctdnep1 は破骨細胞分化を負に制御します。さらに、Ctdnep1 のノックアウトによりリン酸カルシウムの吸収も増加し、骨吸収における Ctdnep1 の阻害的役割を示唆しています。
最後に、Ctdnep1 ノックアウトによって BMP および TGF-β シグナル伝達経路は変化しませんでしたが、Ctdnep1 欠損細胞では RANKL シグナル伝達経路の産物であるリン酸化 (活性化) タンパク質のレベルが増加しました。これらの結果は、Ctdnep1 による破骨細胞分化の抑制効果は BMP および TGF-β シグナル伝達経路を介してではなく、RANKL シグナル伝達経路および Nfatc1 タンパク質レベルの負の調節を介して媒介される可能性があることを示唆しています。
全体として、これらの結果は破骨細胞分化プロセスに関する新たな知見を提供し、破骨細胞の過剰活動による骨量減少の軽減を目的とした治療法の開発に使用できる潜在的な治療ターゲットを特定します。 Ctdnep1 は骨量減少を特徴とする疾患に加え、小児脳腫瘍である髄芽腫の原因因子としても特定されています。著者らは、この研究が骨代謝以外のヒト疾患にも応用できると楽観視しています。
早田教授は次のように結論づけています。「私たちの研究結果は、Ctdnep1 が過剰な破骨細胞形成を防ぐために必要であることを示唆しています。これらの研究結果は、リン酸化-脱リン酸化ネットワークが破骨細胞の分化を制御する仕組みに関する知識をさらに広げ、過剰な破骨細胞の活動に関連する骨疾患の治療に新たな治療戦略を提供できる可能性があります。」

