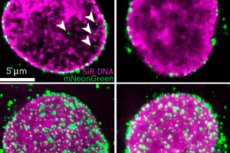
最近の画期的な研究で、科学者たちはHIV-1が細胞の核バリアを貫通する仕組みを解明しました。これは、抗ウイルス戦略のアプローチを変革する可能性のある発見です。ダイアモンド研究所のeBIC所長であるPeijun Zhang教授が率いるこの研究では、最先端のクライオ電子顕微鏡を用いて、ウイルスのライフサイクルにおいて捉えにくいものの重要な段階である核侵入中のHIV-1ウイルス核を画像化しました。
Nature Microbiology誌に掲載されたこの研究成果は、英国国立電子バイオイメージングセンター(eBIC)のクライオ電子顕微鏡(クライオEM)技術によって実現しました。オックスフォード大学のチャン教授の研究室の研究者たちは、細胞自体を破壊することなく細胞膜を透過性にする「細胞透過化」と呼ばれる技術を用いました。彼らはヒト細胞におけるHIV感染過程をシミュレートし、細胞核に埋め込まれた約1,500個のウイルス核を捉えることに成功しました。
この研究では、HIV-1 が核内に侵入できるかどうかは、ウイルス核の形状と柔軟性、核膜孔複合体 (NPC) の適応性、CPSF6 などの宿主因子によって決まることが示されました。
CPSF6 は、HIV-1 感染の初期段階、特にウイルスが核に侵入して宿主ゲノムに組み込まれる際に重要な役割を果たす宿主細胞タンパク質です。
これまで、核膜孔複合体は特定の分子のみを通過させる硬く固定された構造であると考えられていました。しかし、この研究では、核膜孔ははるかに柔軟であり、HIV粒子(ウイルスコア)の通過を可能にするために拡張したり形状を変えたりできることが示されました。
しかし、すべてのウイルスコアが核内に入るわけではありません。コアが脆すぎたり、CPSF6タンパク質と相互作用できなかったりすると、核孔に閉じ込められたり、核孔の外側に留まったりします。これは、核孔が単なる受動的な「扉」ではなく、どのウイルスが侵入できるかを決定する能動的な役割を担っていることを意味します。これは、HIV感染とウイルスが細胞とどのように相互作用するかに関する根本的に新しい理解です。
ヒト免疫不全ウイルス1型(HIV-1)は、1981年に初めて症例が報告されて以来、人類の健康にとって最も深刻な脅威の一つであり、毎年4,200万人以上の死者と100万人以上の新規感染者を出しています。今回の発見は、HIV-1に関する理解を深めるだけでなく、複雑な細胞プロセスを解明するin situ構造生物学の威力を示すものです。
この研究は、HIV を危機的な段階で視覚化し、それを阻止できる可能性がある方法を理解する上で大きな進歩を表しています。

